- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 动植物组织透明化试剂 主动式组织透明化/染色系统 SHIELD 透明化试剂 AMIRA三维视图和分析软件
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 组织切片透明&膨胀试剂盒(试用装) 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒
- 组织透明化及成像服务
- 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像 PhotoSound小动物活体荧光成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 生物3D打印设备
- RegenHU生物3D打印机
- 试剂耗材
- GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 内窥拉曼系统
- 高信噪比内窥拉曼系统
- 循环肿瘤细胞捕获计数平台
- ISET循环肿瘤细胞捕获仪
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
mRNA体内递送载体有哪些?
发布日期:2021/5/19 16:41:56

早期人们采用聚合物材料来进行核酸的递送,如聚乙烯亚胺(polyethylenimine,PEI)、聚氨基酯(PBAE)、壳聚糖等。大多数用于mRNA递送的聚合物材料都需要进行脂肪酸链的修饰,以改善其安全性,但这些材料的应用目前都只停留在临床前研发阶段。有研究就采用PEI用于将DNA通过吸入的方式输送到肺部。然而PEI不易分解,因此对于可能需要的重复给药,聚合物可能累积并引起副作用。【1】也有研究采用分支型的聚胺基聚合物进行mRNA的包载,构建一套树状聚合物RNA纳米粒,并成功在体内表达出了对抗翟卡病毒、埃博拉病毒的相关抗体。【2】
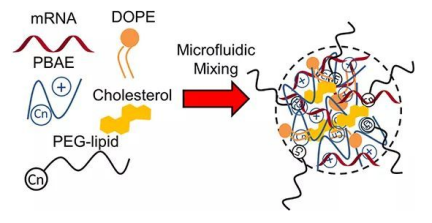
图1. 麻省理工研究团队采用
聚合物材料制备的mRNA纳米粒【1】
(三)脂质纳米粒
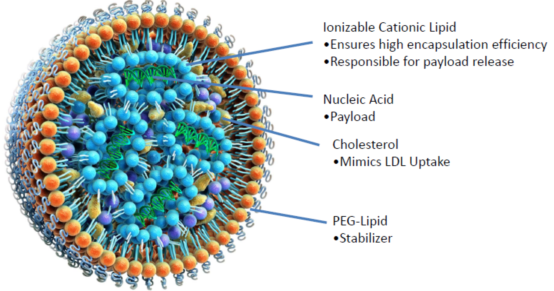
最早人们采用离子化的脂质进行siRNA的递送,并在2018年由Alnylam制药公司推出了上市的RNAi药物Onpattro,其就是通过离子化的脂质制备的脂质纳米粒(Lipid nanoparticles,LNPs)进行siRNA的包载和递送。受其启发,目前研究者们也纷纷选择LNPs作为mRNA递送的载体。LNPs主要通过阳离子的磷脂材料与其他辅助磷脂完成颗粒的构建,通过RNA所带的负电与阳离子磷脂的正电相互吸附,可实现较高的包载效果,并且在体内由低密度脂蛋白介导的胞吞机制可使纳米粒子成功被细胞摄取,实现良好的细胞摄取效果。在胞内经由内含体途径将mRNA成功释放,转运到细胞质中进行表达,产生相应的蛋白表达。同时良好的体内安全性也使他更具竞争力,在多种传染性疾病的预防及治疗方面展现出了较好的效果。其中已有大量的研究已经进入了临床研究阶段,如在两项临床一期的流感病毒疫苗研究中,通过LNPs包载核苷酸修饰的mRNA,所产生的机体免疫应答与传统的灭活流感病毒疫苗相似,并且安全性也基本一致。【4】在新冠疫情的背景下,辉瑞与Biotech的mRNA疫苗更是紧急上市,同样采用LNPs作为mRNA的递送载体,并展现出了超过90%的有效率。
参考文献:
1. James Cliff Kaczmarek, Kevin J Kauffman et al.: Optimization of a Degradable Polymer-Lipid Nanoparticle for Potent Systemic Delivery of mRNA to the Lung Endothelium and Immune Cells. Nano Lett 2018, DOI: 10.1021/acs.nanolett.8b02917.
2. Chahal JS, Khan OF, Cooper CL et al.:Dendrimer-RNA nanoparticles generate protective immunity against lethal Ebola, H1N1 influenza, and Toxoplasma gondii challenges with a single dose. Proc Natl Acad Sci USA 2016,113:E4133-4142.
3. Udhayakumar VK, De Beuckelaer A et al.: Arginine-rich peptide-based mRNA nanocomplexes efficiently instigate cytotoxic T cell immunity dependent on the amphipathic organization of the peptide. Adv Healthc Mater 2017, 6.
4. Feldman RA, Fuhr R et al.: mRNA vaccines against H10N8 and H7N9 influenza viruses of pandemic potential are immunogenic and well tolerated in healthy adults in phase 1 randomized clinical trials. Vaccine 2019, 37:3326-3334.
