- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 AMIRA三维视图和分析软件 高速固态硬盘
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装) 骨组织透明化试剂盒 上皮或结缔类组织透明化试剂盒 非固定形态类软组织透明化试剂盒 肿瘤或致密组织透明化试剂盒 颅骨-脑组织透明化试剂盒 植物透明化试剂盒 活体颅骨透明化试剂盒 整鼠透明化试剂盒 Lectin血管标记物 PBS缓冲液 4%多聚甲醛固定液(PFA)
- 组织透明化及成像服务
- 单细胞空间多组学与高通量蛋白质组学科研检测服务 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 超快超分辨功能超声成像系统
- 超快超分辨功能超声成像系统
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
- 生物3D打印设备
- RegenHU生物3D打印机
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
阳离子脂质 or 中性脂质?pDNA包封配方对比
发布日期:2024/7/15 13:50:05
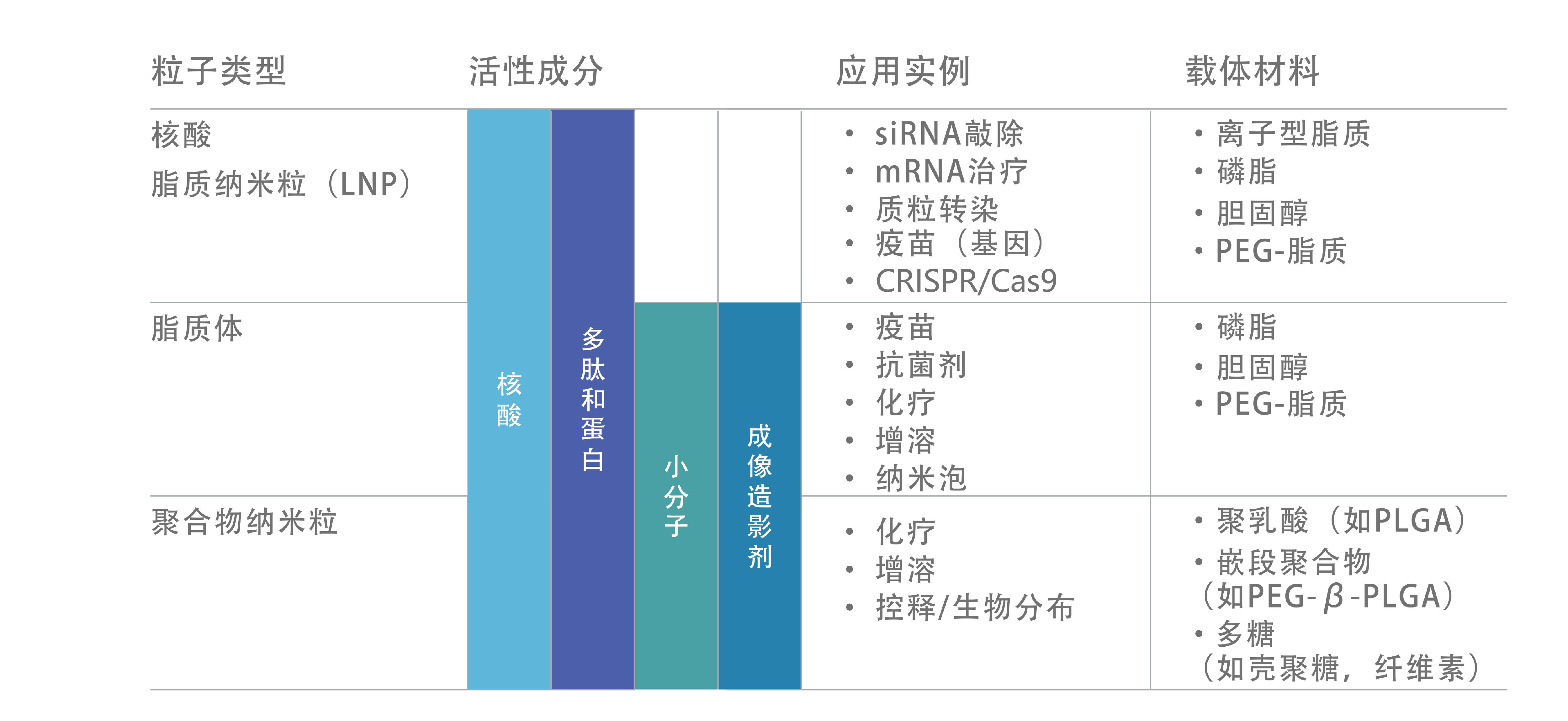
近年来,微流控技术已成为新型冠状病毒疫苗后基因治疗纳米药物(Nanomedicines,NMeds)生产的主流技术;然而,对每种纳米药物类型和遗传物质进行优化仍然是该类药物研发的必备流程,且多为针对mRNA的方案。在此背景下,Ilaria Ottonelli等人尝试优化核酸脂质纳米粒(Lipid nanoparticles,LNPs)装载、保护和递送pDNA的方案,同时尽可能降低其毒性。
在文章中,作者首先探究不带阳离子脂质的中性脂质体(Liposome)。仅使用DPPC和胆固醇两种成分,通过改变配比发现更高比例的胆固醇能够获得更小粒径的脂质体,而流速比则基本不会影响脂质体性质。因而敲定DPPC与胆固醇的比例为1:1。之后作者引入阳离子脂质DOTAP与带荧光的脂质DOPE-Rhod,以形成空包的脂质纳米粒(Lipid nanoparticles,LNPs)。通过不同的配比,发现在阳离子脂质比例不高的情况下,LNP的粒径与PDI均保持良好,但在加入荧光脂质后,粒径和PDI均有正相关趋势(图1)。在共计12组实验中,DPPC : Chol : DOTAP = 1 : 1 : 0.1,且加入定量10 μg荧光脂质的粒径和PDI较为理想,因此后续的实验作者均使用了该配比。
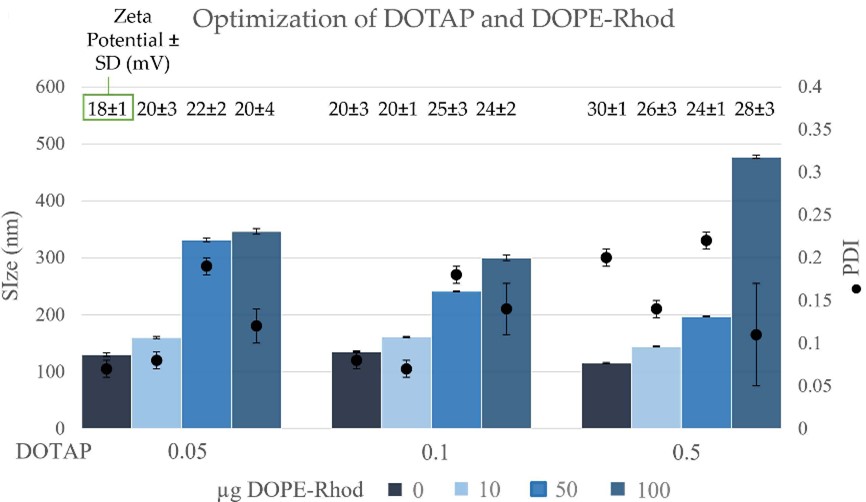
图1 不同比例的DOTAP与DOPE-Rhod对LNP粒径和PDI的影响
目前对于合成包裹有核酸的脂质纳米粒,较为主流的方法是将核酸作为水相的成分,在形成脂质纳米粒时直接进行包裹。但也有些科研工作者使用与传统转染试剂盒类似的方式,先合成空包的脂质纳米粒,再与核酸进行“孵育”,使核酸与脂质纳米粒结合,形成最后具有功能的LNP。在文中,作者将前一种主流方法称为“前添加法(Pre-addition strategy)”,而后一种成为“后添加法(Post-addition strategy)”(图2),并比较了这两种方法合成的LNP的表征结果(图3)。
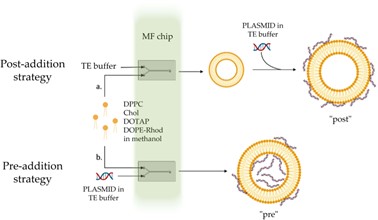
图2 两种合成最终LNP方法的比较图
对于含有阳离子脂质的脂质纳米粒,使用“后添加法”包裹不同量的核酸(5 – 15 μg/mL),其粒径和PDI随着核酸浓度的提升而线性增加(150 nm,PDI ~0.1变化至250 nm,PDI>0.4)。尽管保持几乎100%的结合率,但作者认为其稳定性极差,无法用于后续的实验。而使用“前添加法”,包封率仍能保持近乎100%,且核酸量的增加并不会对LNP的粒径和PDI造成明显影响。因此作者持续增加核酸浓度,直到100 μg/mL才出现了负面影响,但仍然要好于“后添加法”。同时Zeta电位开始下降,这可能与LNP内部核酸接近饱和,开始聚集在粒子表面有关。另外,该“不理想”的LNP稳定性较好,4℃保存30天后的粒径和PDI仍十分稳定。
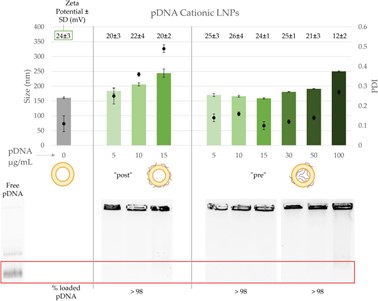
图3 带有阳离子脂质的脂质纳米粒包裹pDNA表征结果
鉴于上述结果,作者也尝试使用中性脂质体进行pDNA的包裹(图4)。与预料类似,因缺乏能与核酸进行静电吸附的阳离子,中性脂质体包裹效果差于阳离子脂质纳米粒。其中使用“后添加法”进行pDNA包裹,其结合率极低(<5%);“前添加法”尚且能达到50%左右的包封率,且粒径(150 nm)和PDI(<0.15)处于可接受范围内。
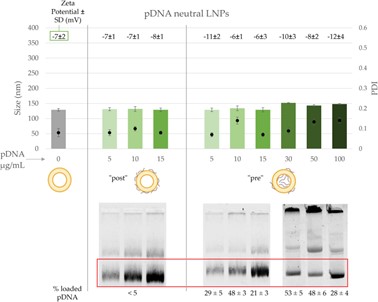
图4 中性脂质体包裹pDNA表征结果
结合上述各实验我们不难发现,使用“前添加法”,例如微流控等一步合成方法,具有较为优越的粒径、PDI、包封率以及稳定性,是合成各类核酸脂质纳米粒的首选方法。
此后作者也同样进行了核酸酶保护、毒性和细胞摄取等测试,发现该LNP同样具有低细胞毒性(40 μg/mL)和快速细胞摄取(2小时内)的特性,再次验证了LNP作为基因治疗工具的能力。
参考文献:
[1] Ottonelli I, Adani E, Bighinati A, Cuoghi S, Tosi G, Vandelli MA, Ruozi B, Marigo V, Duskey JT. Strategies for Improved pDNA Loading and Protection Using Cationic and Neutral LNPs with Industrial Scalability Potential Using Microfluidic Technology. Int J Nanomedicine. 2024;19:4235-4251
铭汰Microflow系列微流控纳米药物递送平台

【CRO/CMO】纳米药物研发、制造与生产外包
随着纳米技术的不断发展,纳米药物在医药领域的应用越来越广泛,尤其在基因治疗,肿瘤靶向等方面显现了不可替代的优势。锘海生物科学为科研工作者和企业提供全面的纳米药物制备、生产及检测服务,囊括了纳米药物研发过程中,从处方筛选到制剂表征的全线过程。为客户简化流程,节约时间成本,同时提供高质量的数据分析与技术支持服务。
技术服务方案选择
◆ 纳米颗粒制备 ◆
客户确定载体和API以及已有的制备protocol,锘海为您提供纳米制剂制备服务,同时检测颗粒的粒径和包封率。
◆ 科研课题外包 ◆
针对科研客户,锘海提供相关课题的完全外包服务。根据您选择的载体和API,帮助您优化和确定处方并完成制备纳米制剂,提供检测报告和protocol。利用锘海纳米制备核心技术平台,提供一站式服务,让您花同样的时间得到多的结果,减少由于技术瓶颈和人员变化带来的实验波动。助您在短的时间,发出高分的文章!
◆ 企业研发与生产 ◆
针对企业客户,锘海提供从载体选择到纳米制剂制备服务。从载体的筛选,处方优化,以及扩大生产(cGMP级别)锘海提供完整的解决和服务方案。缩短研发项目周期,减少科研与生产人力成本,解决无法扩大生产的技术瓶颈!