- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 AMIRA三维视图和分析软件 高速固态硬盘
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装) 骨组织透明化试剂盒 上皮或结缔类组织透明化试剂盒 非固定形态类软组织透明化试剂盒 肿瘤或致密组织透明化试剂盒 颅骨-脑组织透明化试剂盒 植物透明化试剂盒 活体颅骨透明化试剂盒 整鼠透明化试剂盒 Lectin血管标记物 PBS缓冲液 4%多聚甲醛固定液(PFA)
- 组织透明化及成像服务
- 单细胞空间多组学与高通量蛋白质组学科研检测服务 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 超快超分辨功能超声成像系统
- 超快超分辨功能超声成像系统
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
- 生物3D打印设备
- RegenHU生物3D打印机
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
miRNA-200-LNPs可促进小鼠肠上皮再生
发布日期:2023/12/26 13:10:04
肠上皮在损伤后会经历再生过程,这一过程的破坏可能导致炎症性肠病和肿瘤的发生。肠干细胞(ISCs)对于维持肠上皮稳态、促进其损伤后再生至关重要。然而,作为microRNA (miRNA)生物发生的关键成分,Dgcr8在肠道再生中的实质功能却知之甚少。
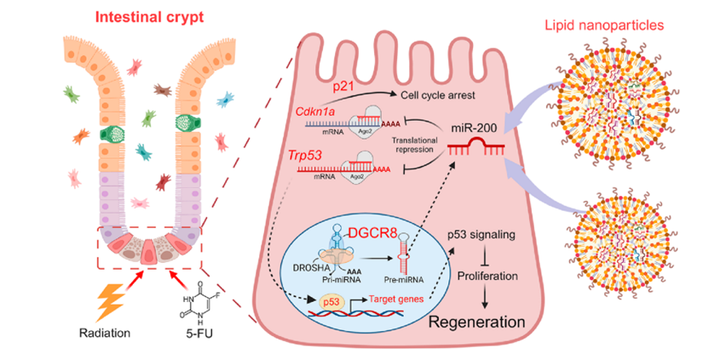
图1. miRNA-200-LNPs促进小鼠肠道再生示意图
1.Dgcr8缺乏会削弱5-FU处理后的肠道再生
-eb4725bd-8626-4cde-a741-edcbe834c40e.png)
图2. Dgcr8的缺失会破坏肠上皮中miRNA的生物发生
-e81b9779-7251-4d69-a0a5-55e62d17a3e7.png)
图3. Dgcr8对于辐照后的肠道再生必不可少
2. Dgcr8是肠道类器官形成和ISC维持所必需的
-ed8ab060-b161-4104-9ab5-141ace8a57c9.png)
图4. Dgcr8是肠道类器官形成和ISC维持所必需的
3.Dgcr8缺失肠中p53通路过度激活
-f04fbd9e-4c62-4241-9974-b2841259d2ca.png)
图5.Dgcr8缺乏诱导p53通路的过度激活
4.p53通路的衰减促进Dgcr8缺陷上皮的肠道再生
-f1e58378-34e3-446b-8b42-7d4c0973aba1.png)
图6.抑制p53通路促进Dgcr8缺陷小鼠在5-FU诱导损伤后的上皮再生
5.MiR-200家族成员的缺失解释了Dgcr8缺陷细胞中p53的激活
-200a4f6b-f1f0-4fc4-b29d-acee415e0bb4.png)
图7. miR-200家族的缺失导致肠上皮中p53通路的过度激活
小 结
参考文献:
[1] Wei X, Yu S, Zhang T, Liu L, Wang X, Wang X, Chan YS, Wang Y, Meng S, Chen YG. MicroRNA-200 Loaded Lipid Nanoparticles Promote Intestinal Epithelium Regeneration in Canonical MicroRNA-Deficient Mice. ACS Nano. 2023 Nov 28;17(22):22901-22915. doi: 10.1021/acsnano.3c08030. Epub 2023 Nov 8. PMID: 37939210; PMCID: PMC10690841.

-7c50f9ab-f569-4417-b068-92c2fd29afe3.jpg)