- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 SHIELD 透明化试剂 AMIRA三维视图和分析软件
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装)
- 组织透明化及成像服务
- 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 生物3D打印设备
- RegenHU生物3D打印机
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
探索mRNA-LNPs: 制备与作用过程全解析
发布日期:2023/9/14 10:03:40
mRNA-LNPs的生成
mRNA由DNA转录而来,经纯化后可作为mRNA-LNPs合成的有效载荷。未修饰的mRNA分子会被细胞RNA感应器识别,从而激活先天免疫反应,因此,核苷修饰也被认为是mRNA为基础的治疗领域中重要的突破之一。
LNPs通常由四种成分组成:磷脂、胆固醇、“隐形”脂质和可电离脂质。“隐形”脂质常用PEG分子,虽然PEG常被认为是非免疫原性的,但抗PEG抗体已经被检测出来,它的出现会加速LNPs的血液清除并激活经典的补体途径,因此,PEG脂质的占比不能太高;可电离脂质在生理PH值下的中性,则有效避免了阳离子脂质引起的直接炎症毒性。
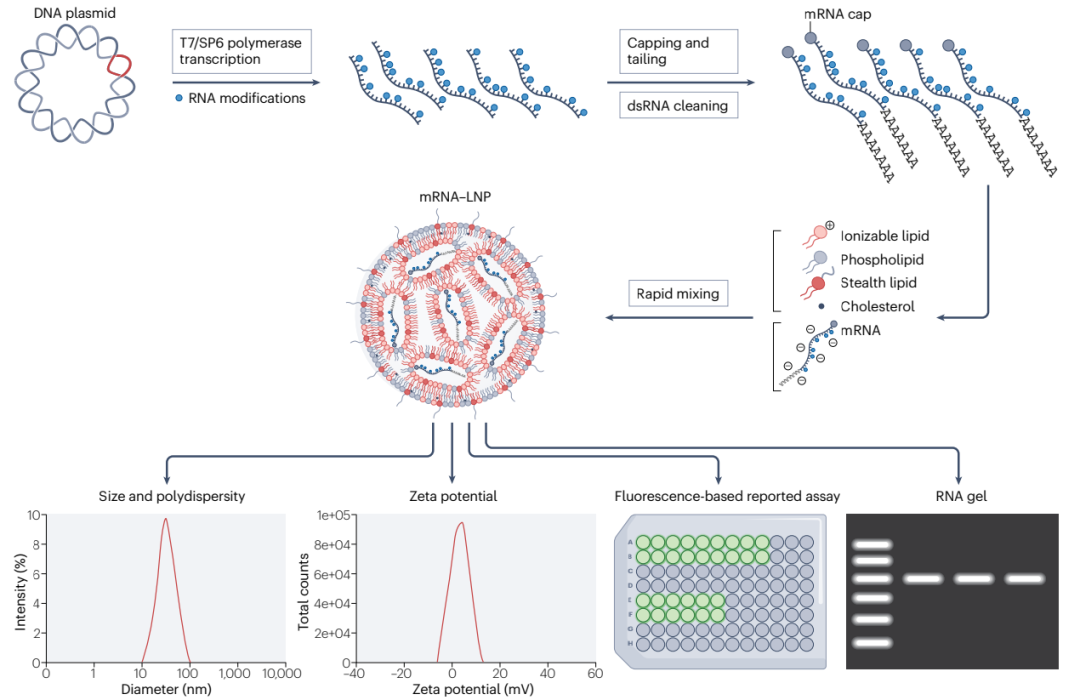
图1. mRNA-LNPs的生成及检测
mRNA溶解于PH 4.0的柠檬酸钠(浓度不高于0.1M)缓冲液,四脂质成分溶解于无水乙醇中,两相即可按特定的比例在微流控设备上进行快速合成。mRNA-LNPs的大小和均匀性可通过动态光散射来验证,表面电荷通过ζ电位测量来确定,酶标仪可用来测定样品的包封率,RNA凝胶则可验证有效载荷的纯度及稳定性(图1)。
mRNA-LNPs传递至细胞
mRNA-LNPs可通过静脉注射等方式进入体内后,通过巨噬细胞和网格蛋白介导的内吞作用进入细胞。内化后的mRNA-LNPs沿内体途径行进:其内部PH值逐渐降低,阳离子脂质发生质子化,并与内体膜相互作用,从而导致LNPs的破裂,在被溶酶体降解之前,有效载荷mRNA被释放出来,这一过程被称为内体逃逸(图2)。mRNA-LNPs的内体逃逸是非常低效的,但释放到细胞质中的mRNA,则能迅速的被核糖体翻译成所需的蛋白质。

图2. mRNA-LNPs胞内作用过程
被动靶向与主动靶向
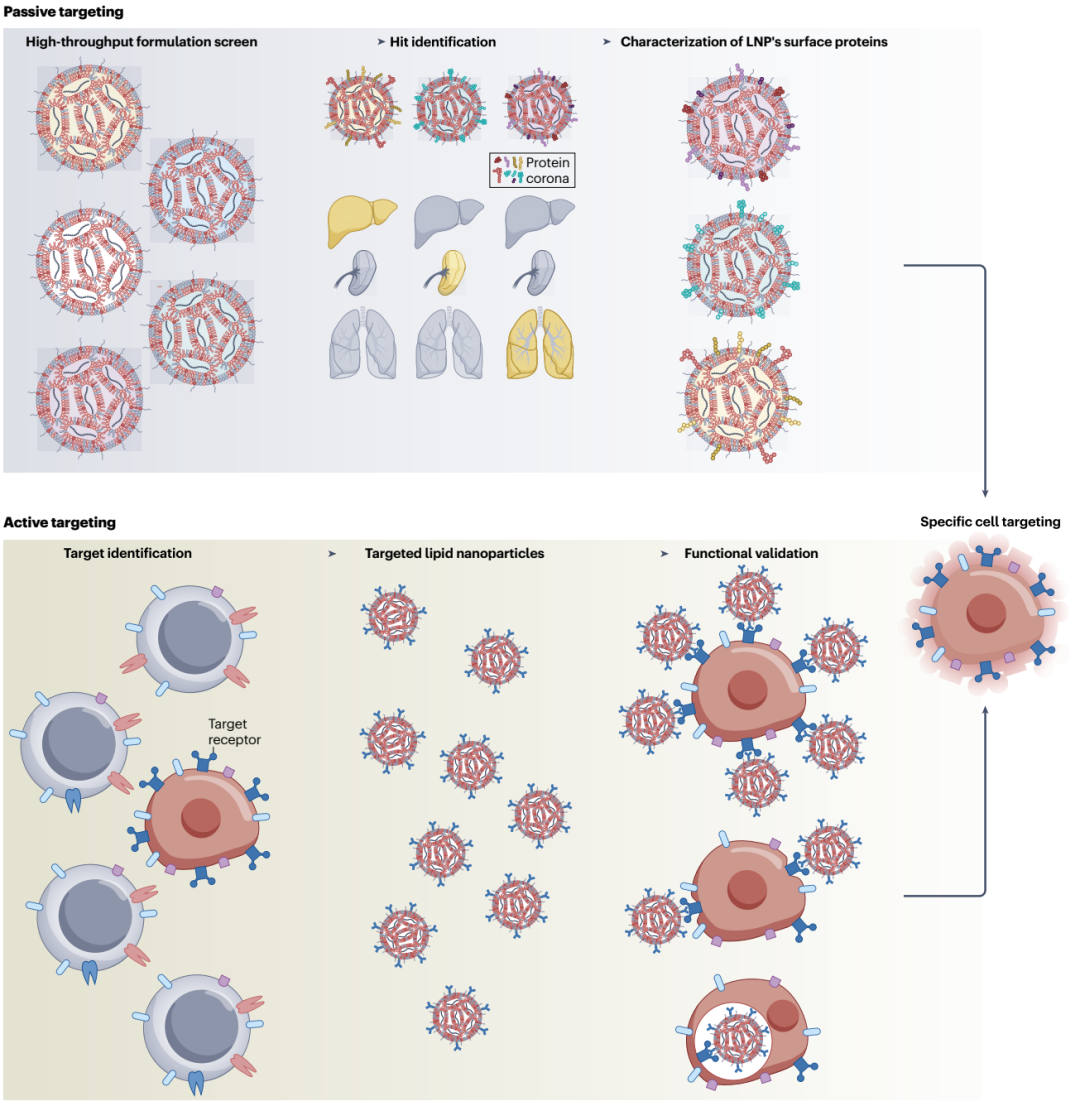
mRNA-LNPs在体内的分布往往呈现随机性,很难按照研究者的设计来进行。总的来讲,mRNA-LNPs的靶向方式可分为两类:被动靶向和主动靶向(图3)。
被动靶向不涉及mRNA-LNPs的修饰,更多依赖于不同粒子在不同组织或肿瘤中积聚的固有倾向。在肿瘤学中,这种方法用于靶向可接近的肿瘤以及非恶性组织,如脾脏和淋巴结,以进行抗肿瘤免疫调节。
主动靶向则需对mRNA-LNPs进行修饰,使其递送到特定的细胞类型。提高纳米颗粒靶向特定细胞类型的能力是扩大其在临床肿瘤学应用的关键。
有两种方法可以功能化LNPs表面的靶向抗体。
第一种为:在LNP的配方中加入“锚定”脂质,颗粒制备后,可以将功能配体偶联到其上(图4),多余的配体则通过层析纯化清除。该方法容易偶联不完整或定向不正确的抗体,例如定向暴露Fc区域的抗体,这可能导致不必要的免疫反应并影响药代动力学特征和分布。
第二种为:在形成的LNPs中添加ASSET胶束,以孵育的方式进行偶联,后添加靶向抗体,将其Fc区域与ASSET中的scFv结构域相互作用,以此来保持抗体的活性构象并控制其在LNPs表面的方向,该方法已成功地将mRNA有效载荷传递至小鼠特定的免疫细胞群和癌细胞。
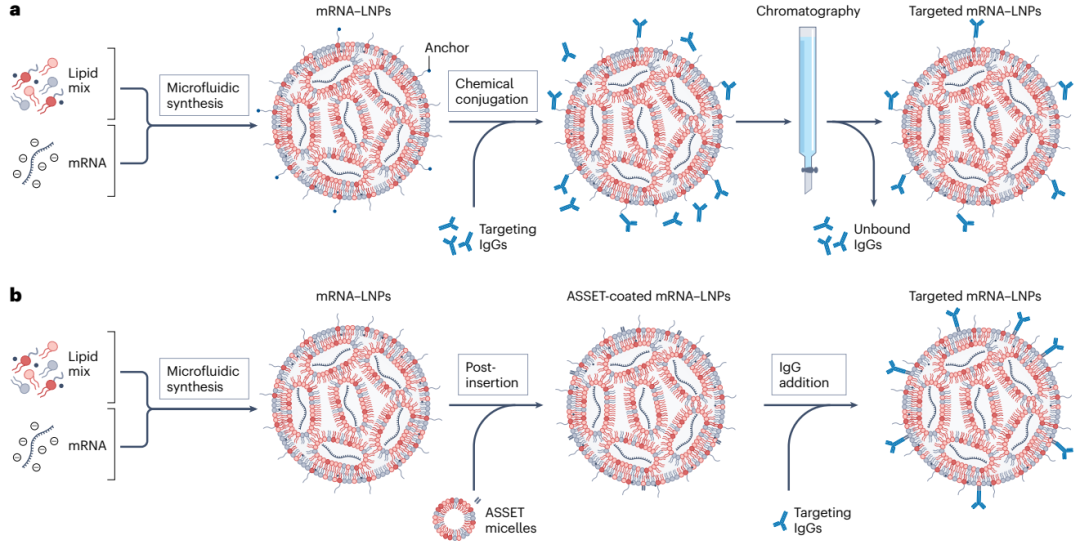
图4.LNPs功能化抗体策略
挑战与展望
在预防新冠的过程中,mRNA-LNPs展示了其良好的功效,但若想扩展其临床应用领域,仍面临着一些需要解决的问题。
(1)mRNA-LNPs的不稳定性:非超低温下的不稳定,是由有效载荷mRNA的固有不稳定性所驱动,并非载体LNPs不稳定。
(2)炎症反应:LNPs并非惰性的,它可能改变宿主体内细胞因子的水平,引发炎症反应。抗PEG抗体的出现可能导致LNPs的快速清除,从而阻碍治疗效果;可电离脂质过长的半衰期也可能引发不良反应,为提高清除效率,下一代可生物降解脂质通常在其疏水尾部结合不稳定的酯键。
(3)特异性和脱靶表达:mRNA-LNPs疗法未来的改进目标即为细胞特异性表达,精准靶向,减少脱靶方可拓展其潜在应用领域。
(4)生产复杂性:设备限制在工艺设计过程中容易被忽视,直至临床规模生产,方才意识到工艺放大难题,在药物开发早期,可及时关注生产相关事宜。
小 结
参考文献:
[1]Kon, E., Ad-El, N., Hazan-Halevy, I.et al. Targeting cancer with mRNA–lipid nanoparticles: key considerations and future prospects. Nat Rev Clin Oncol (2023).
铭汰 Microflow 系列微流控纳米药物递送平台
往期推荐:
●mRNA-LNP(核酸脂质纳米粒)的构效关系
●核酸脂质纳米粒科普——微流控原理

-09-09-5bd73dad-5048-447c-b29d-5ae61b93ca54-9bf40791-0b19-4595-be26-884d32557b8c.jpg)