- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 AMIRA三维视图和分析软件 高速固态硬盘
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装) 骨组织透明化试剂盒 上皮或结缔类组织透明化试剂盒 非固定形态类软组织透明化试剂盒 肿瘤或致密组织透明化试剂盒 颅骨-脑组织透明化试剂盒 植物透明化试剂盒 活体颅骨透明化试剂盒 整鼠透明化试剂盒 Lectin血管标记物 PBS缓冲液 4%多聚甲醛固定液(PFA)
- 组织透明化及成像服务
- 单细胞空间多组学与高通量蛋白质组学科研检测服务 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 超快超分辨功能超声成像系统
- 超快超分辨功能超声成像系统
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
- 生物3D打印设备
- RegenHU生物3D打印机
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
mRNA-LNP(核酸脂质纳米粒)的构效关系
发布日期:2023/8/9 11:47:01
RNA-LNP常通过两相自组装反应进行制备,一相为载体脂质相,另一相为包含API(活性药用成分)的水相,制备所需的设备则是我们已熟知的——微流控设备。
构效关系,可理解为药物的理化性质与其药用活性之间的联系。功效先行,理论滞后,是社会中常见的行事逻辑和行为方式,在mRNA-LNP研究领域也不例外,包括已上市的药物在内,其构效关系也未有清晰准确的阐明。
mRNA-LNP合成过程所涉及的微观动力学尚未清楚,而合成后mRNA-LNP表征手段的不足则更为构效关系的探索增添一份难度。诸多的疑问等待解答:单个纳米颗粒可以装载多少mRNA,mRNA-LNP的包封率和空壳率有着怎样的关系?后处理过程会改变脂质的分布吗?脂质本身的分布是怎样的?如何准确、定量地表征单个纳米颗粒的组分和载药量?这些问题的解答对于实验的设计,工艺的优化,质控的提升,临床风险的降低有着重要的指导作用。对于研究者而言,在细胞/动物实验的基础上,丰富表征手段仍为突破问题的核心。
如图1,mRNA-LNP有各式各样的结构模型,用一些常见的表征,如粒径、PDI、包封率检测等,很难了解其真实样貌。

图1. mRNA-LNP模型图
冷冻电镜(Cryo-EM)
冷冻电镜适用于观测温度敏感型样品,是在普通透射电镜上加装样品冷冻设备,以降低电子束对样品的损伤,减小样品的形变,从而得到更加真实的样品形貌.

图2.LNP的Cryo-EM表征
图2中,A-C直观展示了纳米粒子(复必泰)的形态及粒径分布,也呈现了粒子内部的一些模糊形态;而D则更为清晰的显示出脂质体内水相中硫酸多柔比星晶体的棒状形态。
小角度X射线散射(SAXS)
SAXS是指当X射线过样品时,在靠近原光束2°~5°的小角度范围内发生的散射现象。X射线穿过样品时,在不均一材料电子密度起伏的作用下,会发生散射并形成特定的散射图案,根据所得图案可反推样品微观结构。在进行mRNA-LNP表征时,SAXS常与Cryo-EM结合使用,正如图3所示,结合SAXS检测所得曲线与Cryo-EM拍摄所得图像,即可帮助研究者推断/验证诸多信息,如LNP的多层状结构,各种脂质的排布,纯化前后脂质排布的变化及不同脂质浓度、不同NP比对脂质排布的影响。
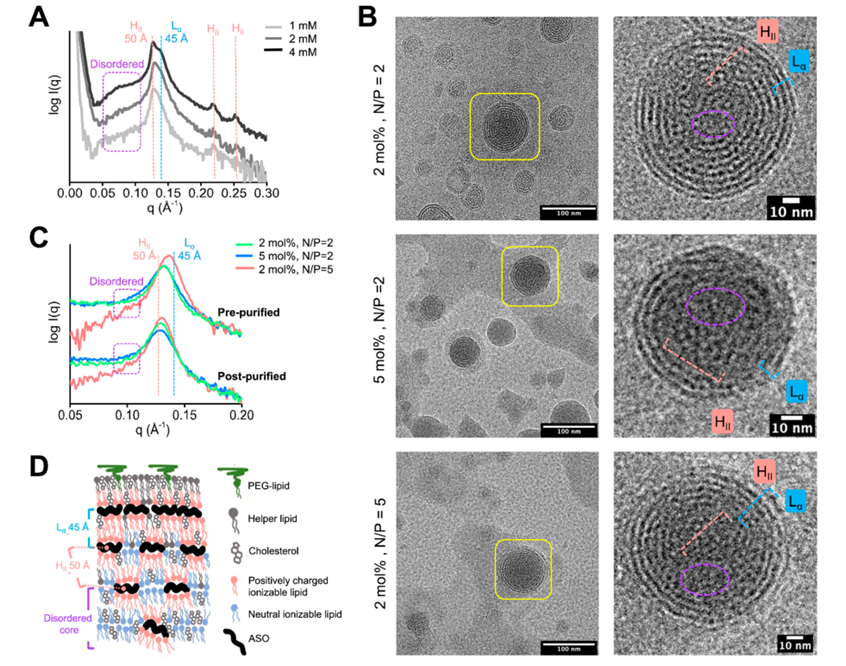
图2.LNP的Cryo-EM表征
多激光圆柱照明共聚焦光谱(CICS)
此方法旨在从单粒子水平上定量解析LNP的有效载荷,通过对LNP不同组分荧光标签的一致性分析和单mRNA荧光的定量解析(图4),区分未封装的mRNA、空载的LNPs和负载mRNA的LNPs。以DLin-MC3基准配方来讲,不同条件下,LNP自组装的空载率为40%~80%,非空载的LNP大多含有2~3个mRNA分子。CICS为揭示LNP动力学控制提供了观测条件,也为mRNA-LNP构效关系的研究给予了新的帮助。
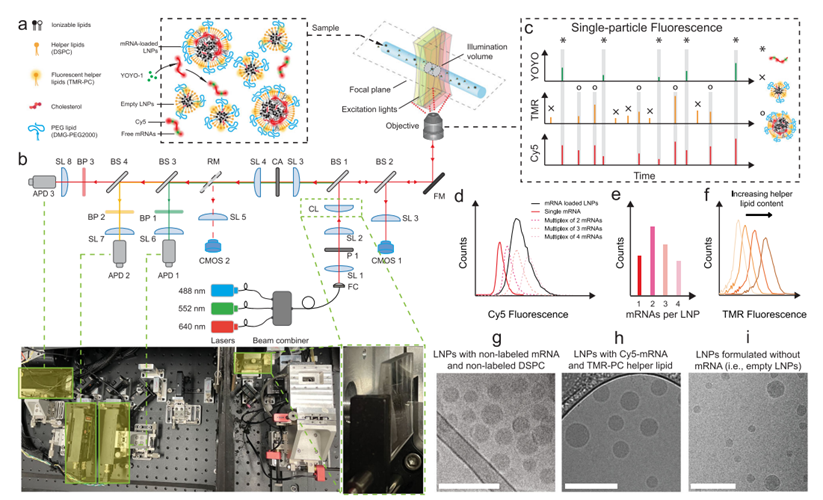
图4. LNP的CICS表征
单粒子分析器(SPP)
SPP采用市售共聚焦显微镜,基于溶液中数千个扩散粒子的荧光波动进行分析(图5a)。简而言之,荧光标记的粒子在衍射受限的观察体中扩散,其发射的荧光在多通道中被连续检测,使用自定义的免费Python脚本可识别多通道的荧光强度波动(图5b),基于多通道中每个单峰的强度,可以构建信号密度图(图5c)和每个通道的直方图(图5d)。
在包封分析中,SPP通过测量mRNA和脂质染料的共现信号(图5f),可以对单个LNP中mRNA的含量进行定量分析,以得到完整LNP的占比(图5g),以及单个LNP的mRNA包封量(图5h)。
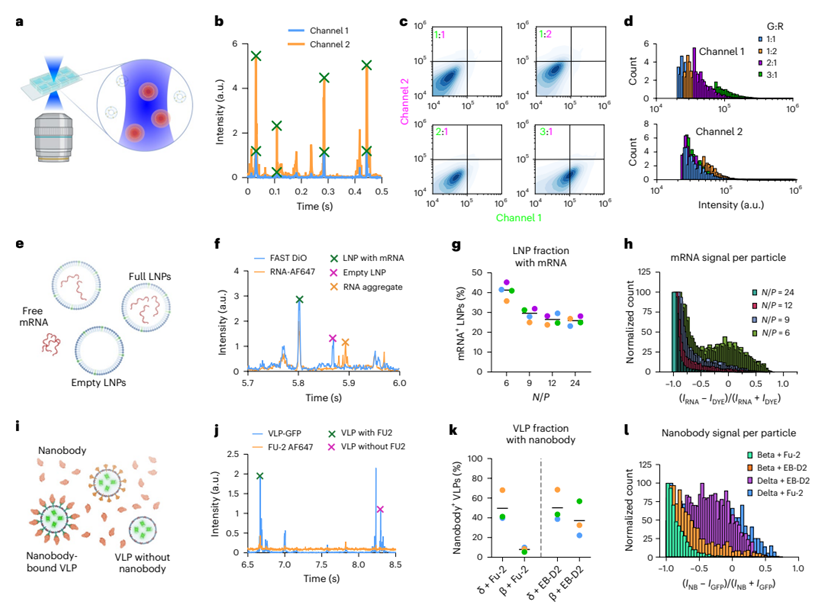
图5.LNP的SPP表征
创建自组装动力学,完善表征手段是揭示mRNA-LNP构效关系的必要方式,文中提到的表征方法,对mRNA-LNP的研究起到了很大的帮助作用,相信随着科技的发展和相关理论的完善,此领域的研究将会取得更大的进展。
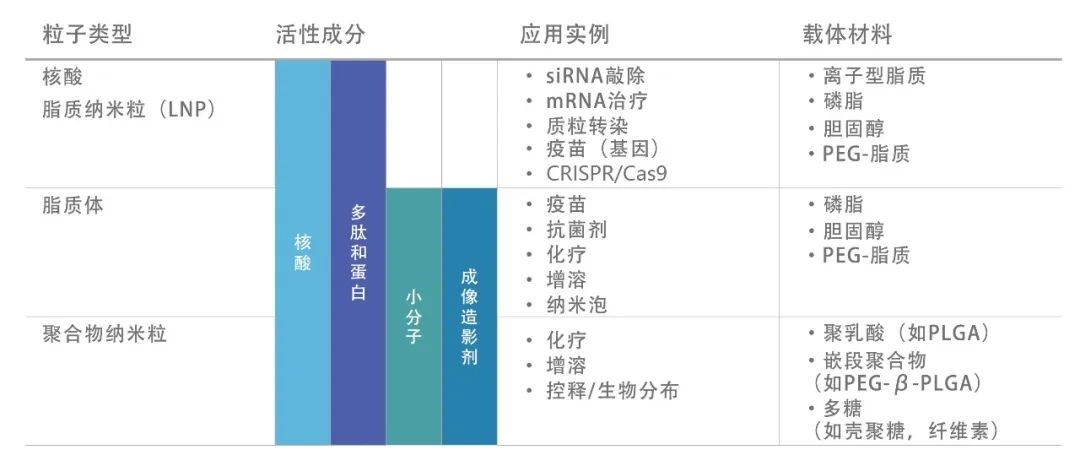
应用范围:
参考文献:
[1] Hammel M, Fan Y, Sarode A, Byrnes AE, Zang N, Kou P, Nagapudi K, Leung D, Hoogenraad CC, Chen T, Yen CW, Hura GL. Correlating the Structure and Gene Silencing Activity of Oligonucleotide-Loaded Lipid Nanoparticles Using Small-Angle X-ray Scattering. ACS Nano. 2023 Jun 27;17(12):11454-11465. doi: 10.1021/acsnano.3c01186. Epub 2023 Jun 6. PMID: 37279108; PMCID: PMC10311593.
[2] Szebeni J, Kiss B, Bozó T, Turjeman K, Levi-Kalisman Y, Barenholz Y, Kellermayer M. Insights into the Structure of Comirnaty Covid-19 Vaccine: A Theory on Soft, Partially Bilayer-Covered Nanoparticles with Hydrogen Bond-Stabilized mRNA-Lipid Complexes. ACS Nano. 2023 Jul 25;17(14):13147-13157. doi: 10.1021/acsnano.2c11904. Epub 2023 Jul 7. PMID: 37417667.
[3] Sych T, Schlegel J, Barriga HMG, Ojansivu M, Hanke L, Weber F, Beklem Bostancioglu R, Ezzat K, Stangl H, Plochberger B, Laurencikiene J, El Andaloussi S, Fürth D, Stevens MM, Sezgin E. High-throughput measurement of the content and properties of nano-sized bioparticles with single-particle profiler. Nat Biotechnol. 2023 Jun 12. doi: 10.1038/s41587-023-01825-5. Epub ahead of print. PMID: 37308687.
[4] Yu H, Angelova A, Angelov B, Dyett B, Matthews L, Zhang Y, El Mohamad M, Cai X, Valimehr S, Drummond CJ, Zhai J. Real-Time pH-Dependent Self-Assembly of Ionisable Lipids from COVID-19 Vaccines and In Situ Nucleic Acid Complexation. Angew Chem Int Ed Engl. 2023 Jun 30:e202304977. doi: 10.1002/anie.202304977. Epub ahead of print. PMID: 37391876.
[5] Li S, Hu Y, Li A, Lin J, Hsieh K, Schneiderman Z, Zhang P, Zhu Y, Qiu C, Kokkoli E, Wang TH, Mao HQ. Payload distribution and capacity of mRNA lipid nanoparticles. Nat Commun. 2022 Sep 23;13(1):5561. doi: 10.1038/s41467-022-33157-4. PMID: 36151112; PMCID: PMC9508184.

-09-09-5bd73dad-5048-447c-b29d-5ae61b93ca54-4821d44b-8b1f-4fcd-b410-2924eaed224b.jpg)