- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 SHIELD 透明化试剂 AMIRA三维视图和分析软件
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装)
- 组织透明化及成像服务
- 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 生物3D打印设备
- RegenHU生物3D打印机
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
核酸药物发展的前沿方向
发布日期:2022/2/25 10:11:18
在上一期的内容中(mRNA疫苗的开发与挑战),我们从四个方面谈了一下对mRNA疫苗开发的了解。相信大家对mRNA疫苗已经更加的熟悉。
关于LNPs合成设备 —— 微流控设备,在实际应用中已长期证明其在合成方面的优良性能。为发掘其更多的使用价值,我们聚焦在了核酸药物发展更前沿的领域。本期,小编将从四个方面介绍核酸药物发展的前沿方向。分别为:CAR-T细胞治疗、靶向mRNA治疗、自扩增mRNA治疗和环状RNA治疗。
CAR-T细胞治疗
CAR-T细胞—嵌合抗原受体(CAR)细胞,是将免疫T细胞在体外进行基因重编程,使其表达能够识别病变细胞上特定抗原的受体蛋白。此外,也可将T细胞靶向抗体修饰在LNPs表面,在体内产生短暂有效的CAR - T细胞。两种制备方式有着相同的优良特性,即大大提升了T细胞的靶向性。CAR-T细胞治疗对于多种疾病的医治都有了实质性的突破,如白血病(1)、心脏纤维化(2)。
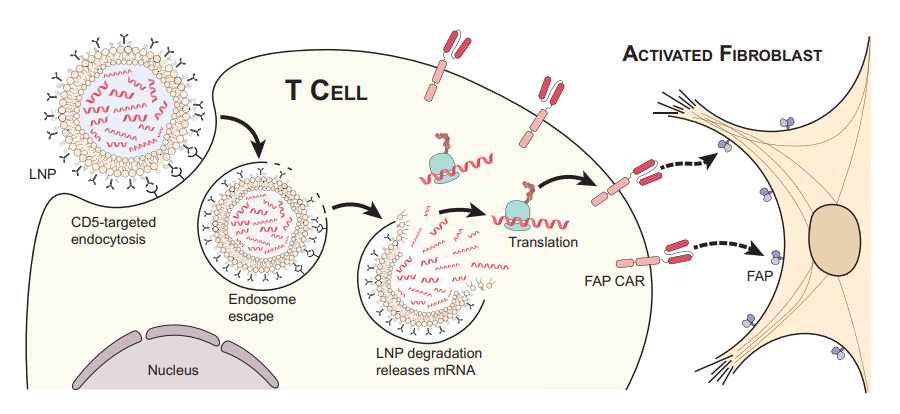
图1.CAR-T细胞靶向过程图
因其技术难度高、治疗风险大、费用昂贵,CAR-T治疗仍然作为其他常规治疗方法无效后的最后手段。
靶向mRNA治疗
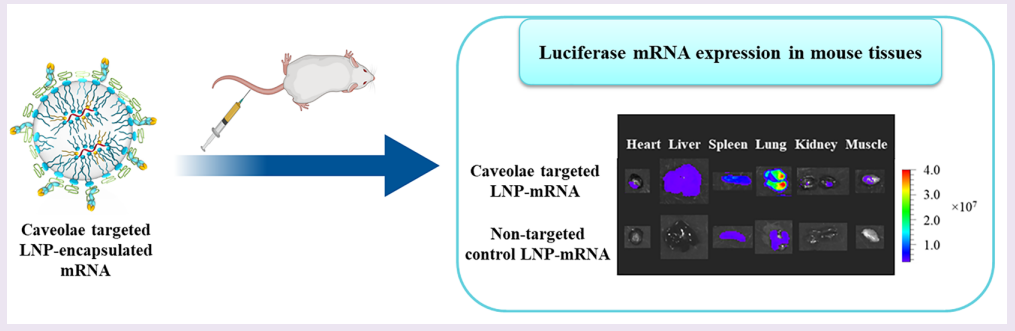
图2.小鼠肺部靶向检测图
自扩增mRNA治疗 环状RNA治疗
环状mRNA是近年来新兴的研究领域。与线性mRNA不同,环状RNA是高度稳定的,共价闭合的环状结构可以保护它免受外切酶介导的降解。有新研究表明,SARS-CoV-2(5)环状RNA疫苗可以在小鼠脾脏内诱导强烈的T细胞免疫应答,而进一步的研究更是显示,该环状RNA疫苗能够对恒河猴产生有效保护。
参考文献
1. Melenhorst JJ, Chen GM, Wang M, Porter DL, Chen C, Collins MA, Gao P, Bandyopadhyay S, Sun H, Zhao Z, Lundh S, Pruteanu-Malinici I, Nobles CL, Maji S, Frey NV, Gill SI, Tian L, Kulikovskaya I, Gupta M, Ambrose DE, Davis MM, Fraietta JA, Brogdon JL, Young RM, Chew A, Levine BL, Siegel DL, Alanio C, Wherry EJ, Bushman FD, Lacey SF, Tan K, June CH. Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. Nature. 2022 Feb 2. doi: 10.1038/s41586-021-04390-6. Epub ahead of print. PMID: 35110735.
2. Rurik JG, Tombácz I, Yadegari A, Méndez Fernández PO, Shewale SV, Li L, Kimura T, Soliman OY, Papp TE, Tam YK, Mui BL, Albelda SM, Puré E, June CH, Aghajanian H, Weissman D, Parhiz H, Epstein JA. CAR T cells produced in vivo to treat cardiac injury. Science. 2022 Jan 7;375(6576):91-96. doi: 10.1126/science.abm0594. Epub 2022 Jan 6. PMID: 34990237.
3. Li Q, Chan C, Peterson N, Hanna RN, Alfaro A, Allen KL, Wu H, Dall'Acqua WF, Borrok MJ, Santos JL. Engineering Caveolae-Targeted Lipid Nanoparticles To Deliver mRNA to the Lungs. ACS Chem Biol. 2020 Apr 17;15(4):830-836. doi: 10.1021/acschembio.0c00003. Epub 2020 Mar 13. PMID: 32155049.
4. Zhang R, Jing W, Chen C, Zhang S, Mohamed M, Sun P, Wang G, You W, Yang Z, Zhang J, Tang C, Du W, Liu Y, Li X, Liu J, You X, Hu H, Cai L, Xu F, Dong B, Liu M, Qiang B, Sun Y, Yu G, Wu J, Zhao K, Jiang X. Inhaled mRNA nanoformulation with biogenic ribosomal protein reverses established pulmonary fibrosis in a bleomycin-induced murine model. Adv Mater. 2022 Feb 11:e2107506. doi: 10.1002/adma.202107506. Epub ahead of print. PMID: 35146813.
5. Qu, Liang, Zongyi Yi, Y. Shen, Liangru Lin, Feng Chen, Yiyuan Xu, Zeguang Wu, Hongxia Tang, Xiaoxue Zhang, Feng Tian, Chunhui Wang, Xia Xiao, Xiaojing Dong, Li Guo, Shuaiyao Lu, Chengyun Yang, Cong Tang, Yun Yang, Wenhai Yu, Junbin Wang, Yanan Zhou, Qingrui Huang, Ayijiang Yisimayi, Yunlong Cao, Youchun Wang, Zhuo Zhou, Xiaozhong Peng, Jianwei Wang, Xia Xie and Wensheng Wei. “Circular RNA Vaccines against SARS-CoV-2 and Emerging Variants.” bioRxiv (2021): n. pag.
纳米药物制备系统
应用范围