- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 AMIRA三维视图和分析软件 高速固态硬盘
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装) 骨组织透明化试剂盒 上皮或结缔类组织透明化试剂盒 非固定形态类软组织透明化试剂盒 肿瘤或致密组织透明化试剂盒 颅骨-脑组织透明化试剂盒 植物透明化试剂盒 活体颅骨透明化试剂盒 整鼠透明化试剂盒 Lectin血管标记物 PBS缓冲液 4%多聚甲醛固定液(PFA)
- 组织透明化及成像服务
- 单细胞空间多组学与高通量蛋白质组学科研检测服务 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 超快超分辨功能超声成像系统
- 超快超分辨功能超声成像系统
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
- 生物3D打印设备
- RegenHU生物3D打印机
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
近红外二区小动物活体成像——高信噪比双成分造影剂协助肿瘤手术成像
发布日期:2021/8/3 13:23:46
在一些生物光学成像中,为了使特定器官或组织形成能够分辨的图像,往往会使用造影剂(Contrast Agent)。然而一般的造影剂在病灶部位聚集相对较少,反而在网状内皮系统(Reticuloendothelial System,RES,如肝脏、脾脏等)大量聚集,使成像存在较高的背景噪音,成像效果大打折扣甚至会影响诊断的结果。通过纳米粒子的高渗透长滞留效应(Enhanced Permeability and Retention,EPR)和体内组装虽然能够一定程度上提升造影剂在肿瘤、炎症部位的聚集,但网状内皮系统中的浓度仍然较高。
在此背景下,Zhao等人创新性地使用镧系元素上转移纳米粒子与近红外二区(NIR-II)纳米探针两者在体内的可控组装与分解,在提高信噪比的同时,延长了其在肿瘤部位的滞留时间。为手术的实时成像提供更为清晰、可靠的方案。
该造影剂由两部分组成:1、β-环糊精(β-CD)修饰的下转移纳米探针(DCNP@β-CD),能够在808 nm的近红外激发光照射下,产生1060 nm的近红外二区(NIR-II)荧光,进行生物成像;2、偶氮苯修饰的镧系上转移纳米粒子(UCNP@Azo),能够在980 nm的近红外激发光照射下,产生365 nm的紫外发射光,使得修饰的偶氮苯发生异构化,由较为稳定的反式(trans-isomer)转变为能量较高的顺式(cis-isomer)。当UCNP@Azo 以反式存在时,能够与DCNP@β-CD组装,形成平均粒径达485 nm的纳米簇;而当UCNP@Azo 以顺式存在时,无法与DCNP@β-CD形成稳定结合,荧光强度大大降低。
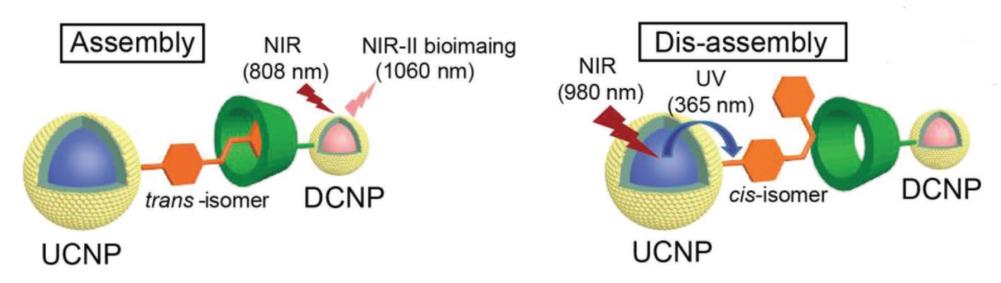
图1:UCNP@Azo与DCNP@β-CD的组装(左)与分解(右)示意图
在实际使用过程中,作者发现相对于将UCNP@Azo与DCNP@β-CD同时注射,先注射UCNP@Azo,过一段时间后再注射DCNP@β-CD得到的荧光强度更高。做系统性对比后得出结论,间隔时间为10 h时,荧光强度达到更大。
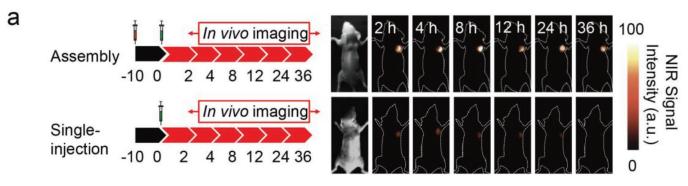
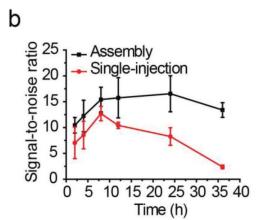
图2:在注射UCNP@Azo后10 h再注射DCNP@β-CD与同时注射两种试剂得到的a)荧光强度对比;b)信噪比对比
同时,可以对作为背景的器官以980 nm的红外光进行照射,降低该器官内的荧光强度,从而提高信噪比。在文章中,作者也对何时照射980 nm近红外光进行了考察。以注射第二种制剂(DCNP@β-CD)为时间原点,在固定两种制剂的注射间隔为10 h后,分别在不同时间点,甚至多个时间点和注射间隔期内进行980 nm的红外光照射,发现在注射第一剂(UCNP@Azo)后9 h时进行照射,将大程度提高信噪比。
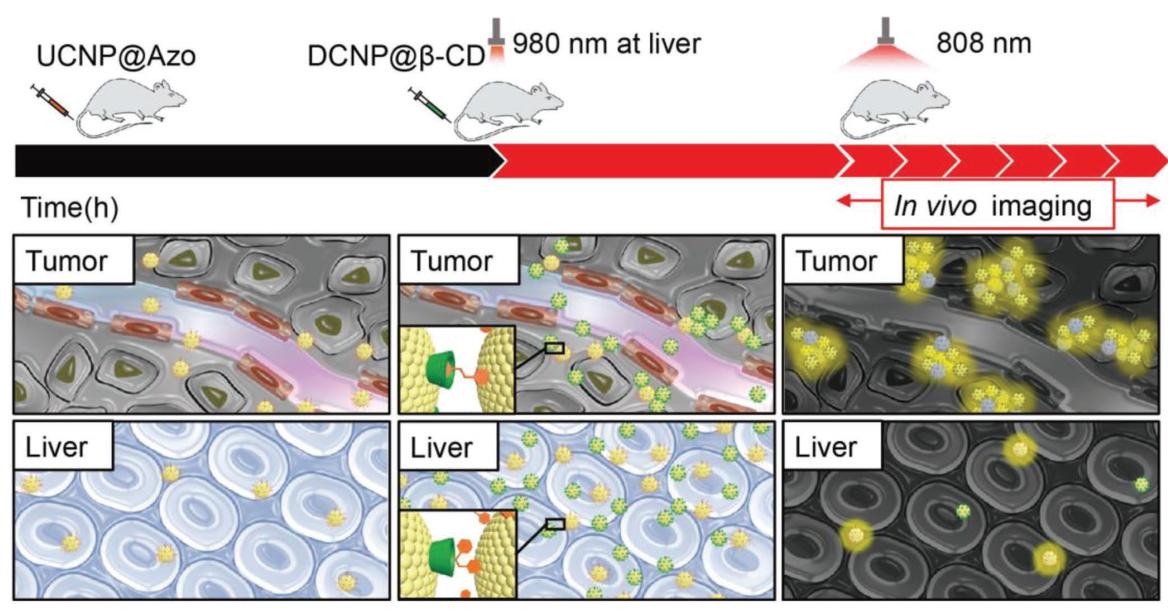
图3:UCNP@Azo与DCNP@β-CD实际操作方式:注射UCNP@Azo、注射DCNP@β-CD并用980 nm近红外光对作为背景的器官或组织进行照射、用808 nm近红外光成像
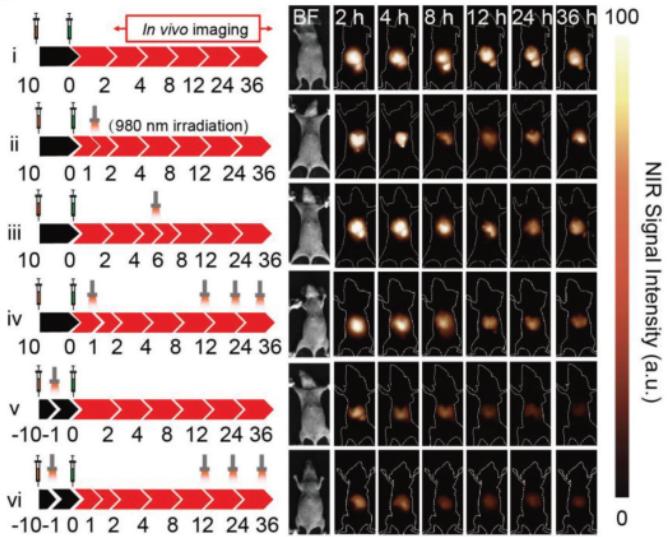
在文章的最后,作者也描述了两种成分的组合将延长在机体内的滞留时间,使得能够进行手术的高信噪比窗口达到了6 h。这无疑为手术成像提供了更多潜力,相信在不久的将来,这项技术能够用于增强生物成像、治疗或其他需要在肿瘤部位聚集大量造影剂的应用领域。
参考文献:
[1] Zhao M, Li B, Wang P, et al. Supramolecularly Engineered NIR‐II and Upconversion Nanoparticles In Vivo Assembly and Disassembly to Improve Bioimaging[J]. Advanced Materials, 2018, 30(52):1804982.
锘海 SWIR 1.0 近红外二区活体荧光成像系统采用低噪声和高灵敏度的进口InGaAs CCD,结合动物气体麻醉装置及便捷的操作界面,实现实时荧光信号成像。通过镜头切换,可分别完成宽场和局部放大成像,具有较高的荧光信号采集能力。高帧频不仅可以实现单幅图片采集,更可以完成视频拍摄,帮助您捕获整个实验过程。

锘海-近红外二区小动物活体成像系统

近红外二区小动物活体成像 —— 稀土纳米颗粒协助肿瘤切除手术
