- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 SHIELD 透明化试剂 AMIRA三维视图和分析软件
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装)
- 组织透明化及成像服务
- 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 生物3D打印设备
- RegenHU生物3D打印机
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
通过微流控技术高效、可放大的制备核酸脂质纳米粒
发布日期:2021/6/30 9:42:23
在过去的一年里,随着全球范围内众多研究者们对mRNA疫苗的广泛关注使得mRNA疫苗、核酸药物等一些原本比较“生僻”的词汇获得了更多的曝光度。人们愈发发现原本应用于罕见病、肿瘤等疾病个性化治疗的核酸药物所具有的无限潜能,其众多优点使得越来越多的人们意识到了下一个药物新时代可能正悄然走来。
而目前的mRNA疫苗、核酸药物多是采用脂质纳米粒(LNP)来实现对mRNA等核酸分子的递送的,目前辉瑞、Moderna等上市的mRNA新冠疫苗以及较早的RNA类药物onpattro都是采用了脂质纳米粒来递送各自的核酸药物,也是目前更受大家认可,研究使用较为广泛的递送体系。与其他递送材料相比,其包封效果、体内外表达效果、体内安全性等多方面都更具优势。这也使得制备得到良好结果、可靠的脂质纳米粒成为了一项重要工作。
目前常用的脂质纳米粒制备方法主要有薄膜水化法、挤出法、均质法等。但是更适合的技术还是采用微流控混合技术来制备核酸脂质纳米粒,该方法相对简便快速,条件温和,同时容易实现生产放大。
如图1所示,通过不同生产规模的微流控机器,可以较好的实现mRNA-LNP的良好制备,其结果一致性良好。粒径结果合适,且具有较低的PDI值,证实其分散性较好,并且包封效果可达90%以上。这些良好的表征结果正是众多研究者们所期待看到的数据。
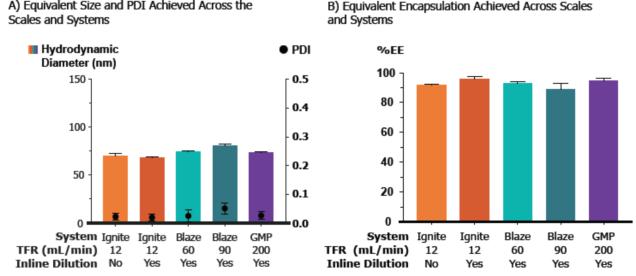
图1. 不同生产规模的微流控机器在不同参数下可以得到一致性良好的结果
此外,在体内实验中也可以进一步验证其效果,如图2、3所示。通过制备包载了EPO-mRNA的LNP(注:EPO,Erythropoietin,促红细胞生成素),经静脉注射给药后,检测小鼠血清中EPO蛋白表达量,可发现相较于空白组明显的EPO蛋白表达提升,并且在不同规模机器间表达水平也比较一致。并在7天后,检测其血细胞容积,也可发现明显的生理指标提升。

图2. 给药EPO-mRNA LNP后小鼠血清内EPO蛋白表达量
通过这些良好的体外表征以及体内表达结果可以发现,采用微流控技术制备的mRNA-LNP的确十分可靠,并且在不同生产规模间实现了一致性的结果,让更多研究者们有理由相信这一技术在mRNA疫苗、核酸药物领域的强大实力。
纳米药物制备系统

应用范围:
点击以下链接,查看往期回顾
大小、结构不同的mRNA-LNP,细胞内的蛋白表达会不同吗?—— 粒径大小篇
mRNA体内递送载体有哪些?
NanoAssemblr制备的LNP实现对CRISPR-Cas9的高效递送
