- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 透明度检测仪 组织透明化染色仪 高频震动切片机 活体循环系统 SHIELD 透明化试剂 AMIRA三维视图和分析软件
- 透明化试剂盒系列
- 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒 皮肤透明化试剂盒 组织切片透明&膨胀试剂盒(试用装)
- 组织透明化及成像服务
- 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 生物3D打印设备
- RegenHU生物3D打印机
- 活体多光子及高分辨显微成像系统
- 高分辨率显微成像系统 双光子荧光寿命计数系统 活体多光子显微成像系统
- 试剂耗材
- 抗体系列产品 GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 小动物灌注/灌流设备
- 小动物灌注系统 灌流设备及附件
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
Science 杂志的“十大突破”之一透明化技术 I 帮您解锁器官三维成像
发布日期:2020/3/23 11:12:27
生物组织的三维特性使得生命科学的研究,如脑部神经投射、血管分布以及肿瘤微环境等,都需基于3D空间信息而进行;但由于不透明大组织对光的散射和吸收,想要对大组织3D成像是个很大的挑战。
组织透明化技术就是把组织内各细胞成分变成折射系数一致或近乎一致,使组织透明,减少对光的散射和吸收。
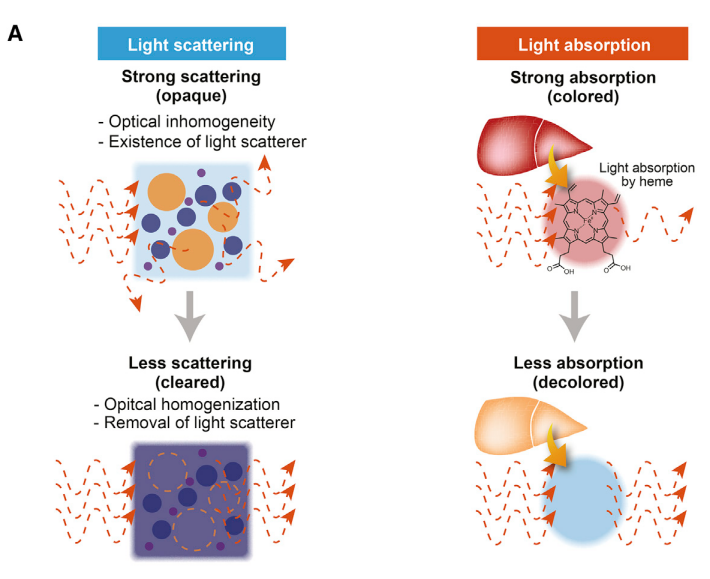
Susaki,E.A.& Ueda,H.R. Cell Chemical Biology (2016)
常见的组织透明化方法
1、疏水透明化方法(油性透明化方法)
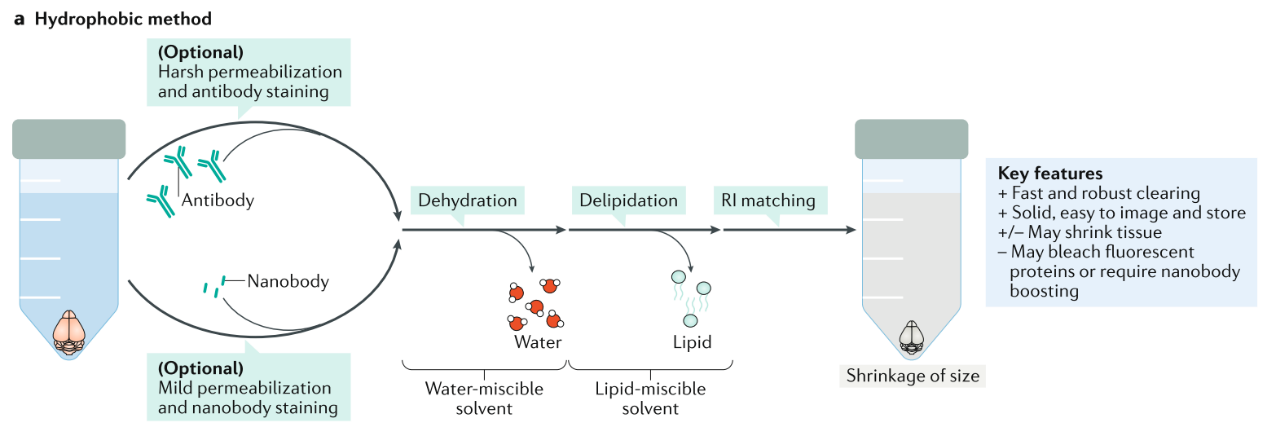
Ueda,H.R.et al. Nature Reviews Neuroscience volume(2020)
3DISCO、iDISCO、uDISCO、 vDISCO, etc.
优点:速度快、组织硬、易于操作。
缺点:刺激性强、组织收缩、荧光易淬灭。
2、亲水透明化方法(水性透明化方法)
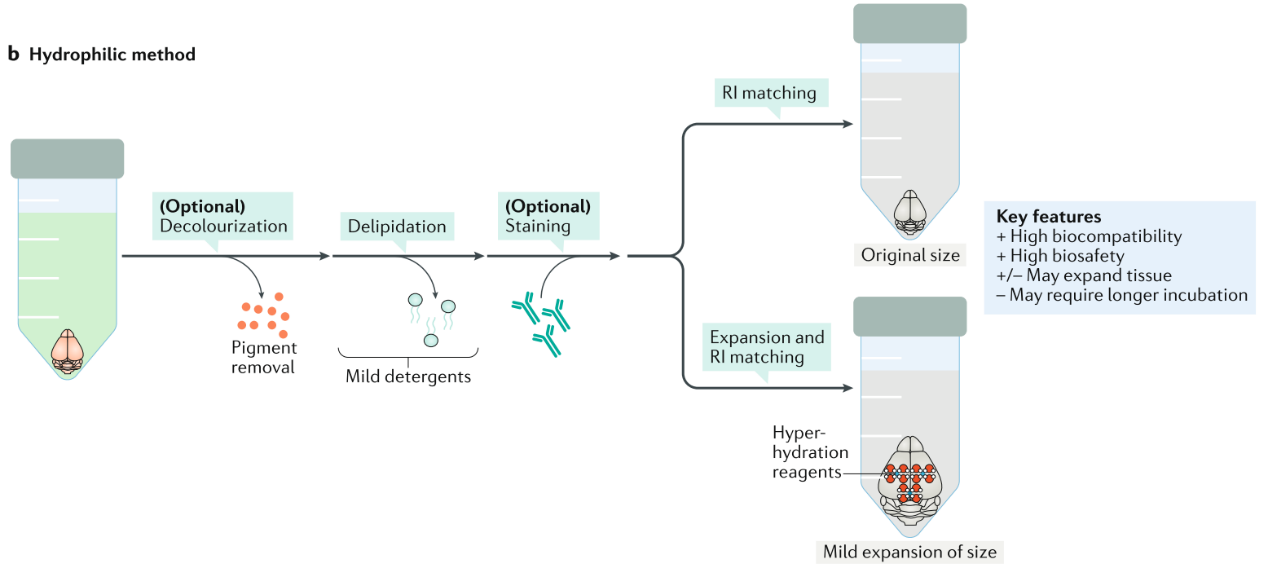
Ueda,H.R.et al. Nature Reviews Neuroscience volume(2020)
Scale、SeeDB、CUBIC、CUBIC-X, etc.
优点:生物相容性好、操作安全。
缺点:组织膨大、速度慢。
3、水凝胶包埋透明化方法
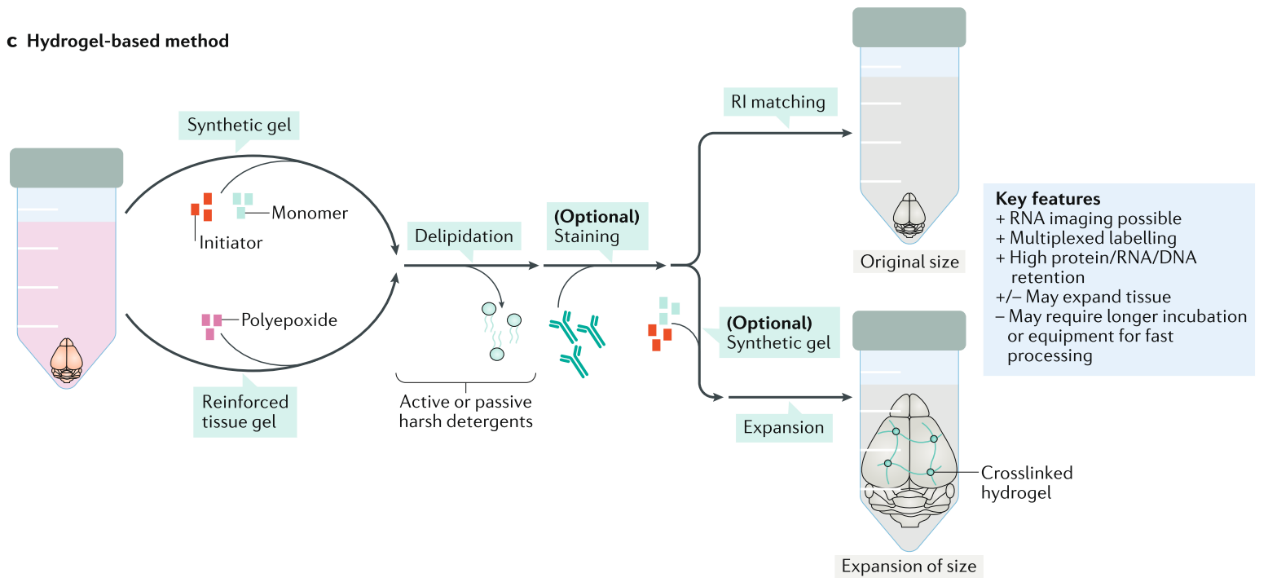
Ueda,H.R.et al. Nature Reviews Neuroscience volume(2020)
CLARITY、PACT、SWITCH、MAP,etc.
优点:DNA/RNA/荧光基团保护性好、可兼容多轮荧光染色标记。
缺点:组织膨大、速度慢、需要设备。
CLARITY的巧妙之处在于其用水凝胶的方法原位固定了整个组织,然后用电泳除去脂质,让大脑变得“透明”进而实现三维成像,此技术改变了研究者看待和研究大脑这个错综复杂器官的方式。
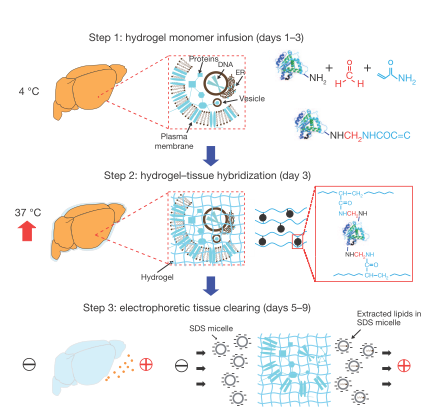
formaldehyde (red), hydrogel monomers (blue)
Chung, K. et al. Nature volume (2013)
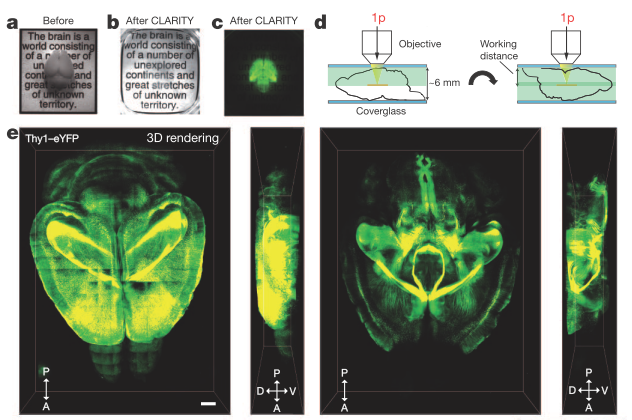
Chung, K. et al. Nature volume (2013)
SHIELD透明化方法
SHIELD几乎是从源头上对CLARITY进行了改进,作者从蛋白质构象保护出发,从上百种化学试剂中筛选出了P3PE,摒弃了丙烯酰胺凝胶包埋的步骤,固定完的样品无需包埋,可直接进行SDS透明化。
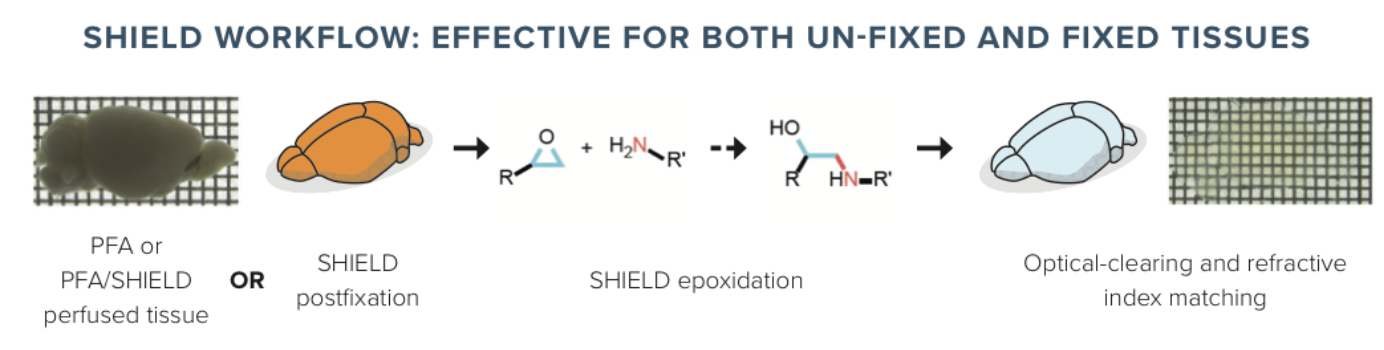
SHIELD优势主要体现在以下几个方面:
Park, Y.G. et al. Nature Biotechnology volume (2019)
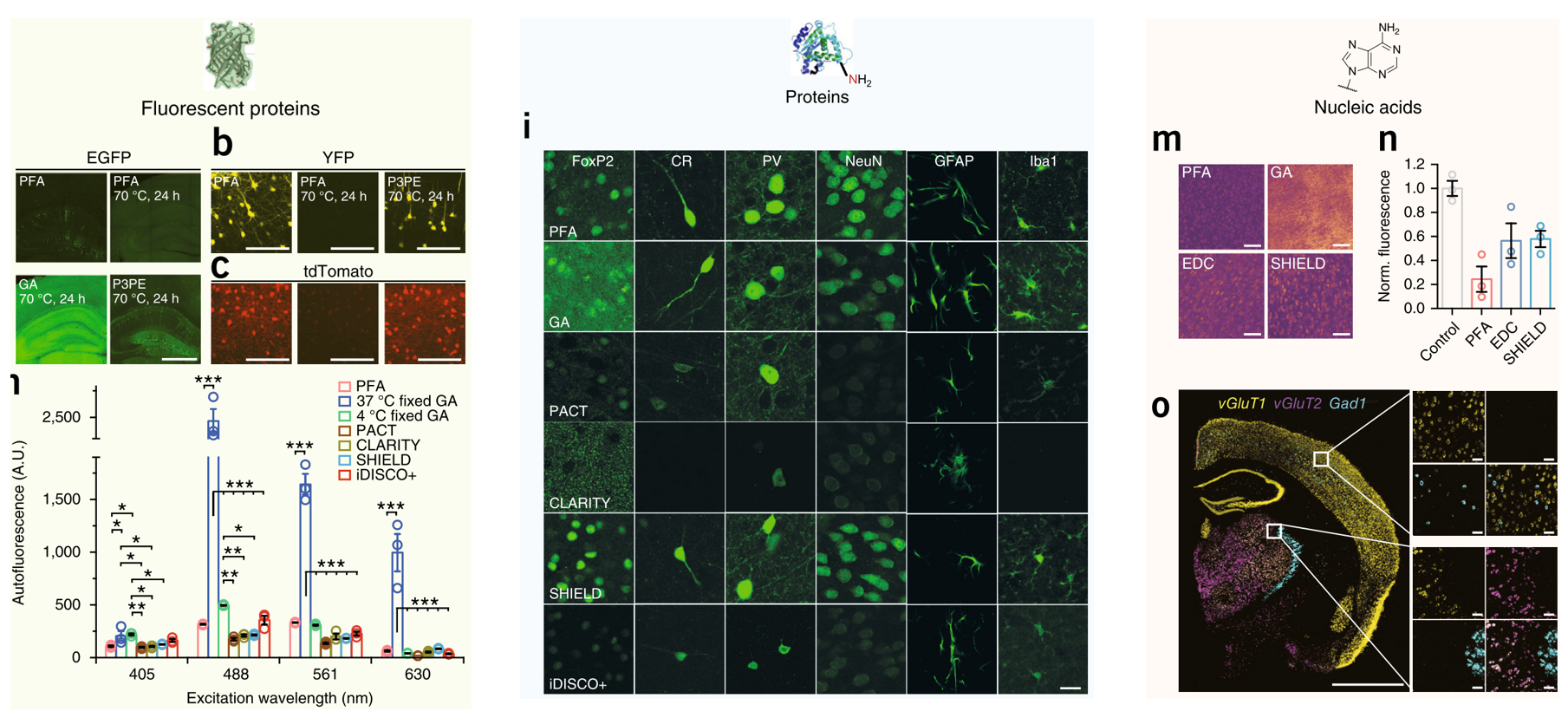
2、SHIELD保护组织结构免受物理和化学压力,保留了荧光信号形态和强度。

Park, Y.G. et al. Nature Biotechnology volume (2019)
3、SHIELD维持了组织的机械强度。

Park, Y.G. et al. Nature Biotechnology volume (2019)
基于SHIELD透明化方法广泛的应用价值,Dr.Chung课题组已逐步将该成果在LifeCanvas Technologies公司实现商业化,它主要由2部分组成:

2、SHIELD透明化仪器Smartclear Pro II

快速均匀组织透明化:
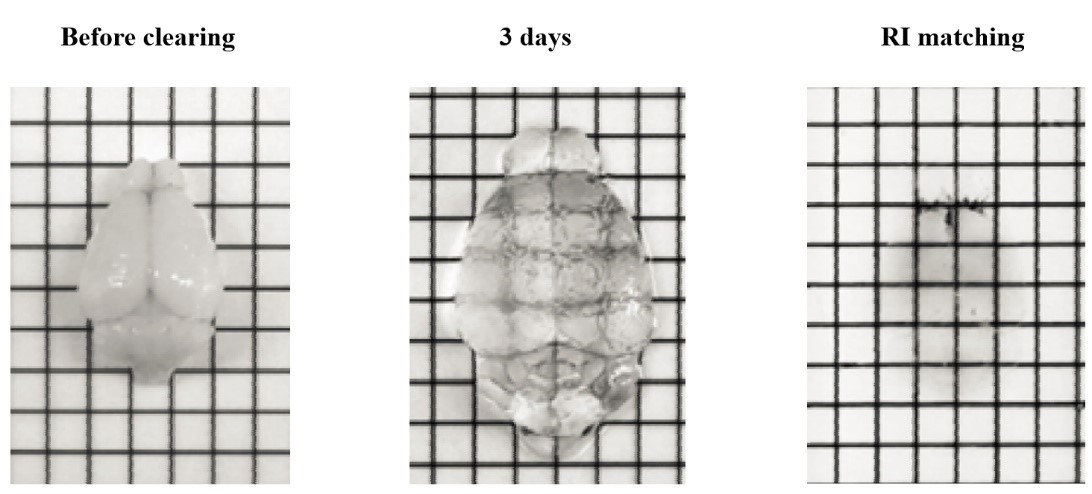
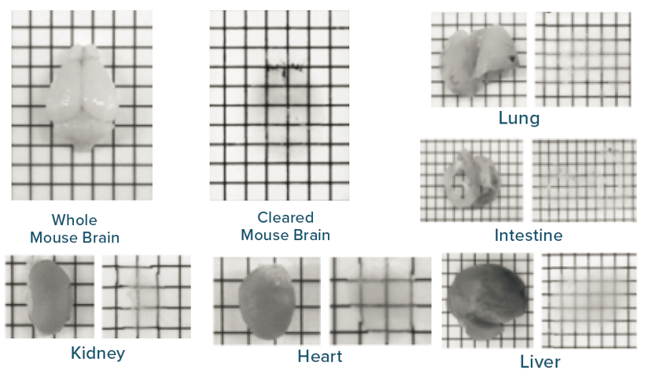
Smartclear Pro II 适用于全脑、肾、心、肺、肠、肝、脾、卵巢、睾丸、肿瘤等多种组织器官的透明化。
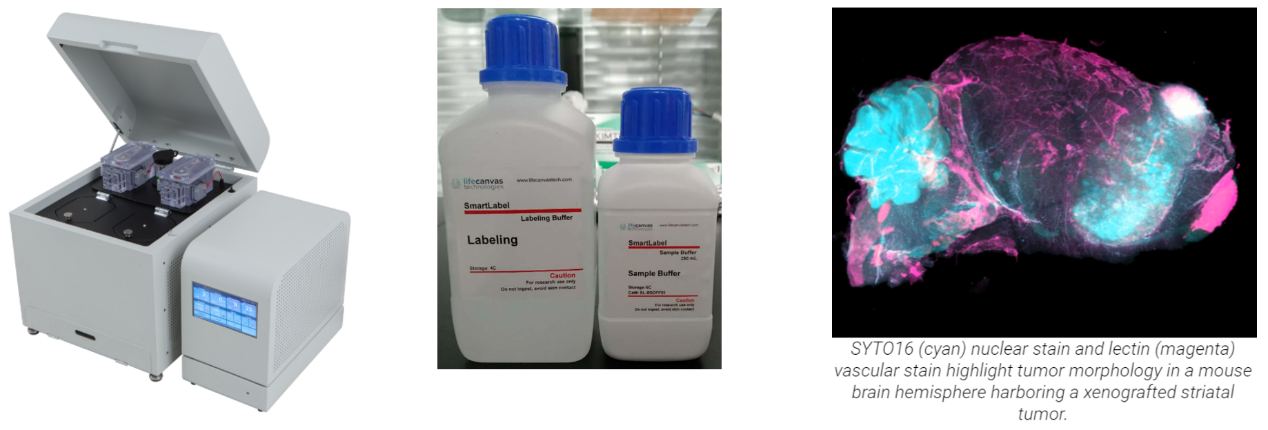
组织智能免疫染色-SMARTLABEL
大组织经过透明化后,运用SMARTLABEL组织智能免疫染色仪,可快速均匀抗体标记,完整展示组织3D特性。
锘海生物科学仪器(上海)股份有限公司提供从完整组织固定、透明化、组织免疫荧光染色、大组织高分辨3D显微成像到大数据分析一体化服务,目前服务客户遍布各大高校和科研院所,购买Smartclear Pro II/SMARTLABEL/LS18光片显微镜的客户单位有清华大学、复旦大学、西湖大学、华东理工大学、昆明医科大学、大连干细胞与精准医学创新研究中心等。
我们旨在通过准确、快速、多样化的一体化研发服务为每一位生命科学工作者提供个体化/定制化解决方案。

参考文献:
1. Susaki,E.A.& Ueda,H.R. Whole-body and Whole-Organ Clearing and Imaging Techniques with Single-Cell Resolution: Toward Organism-Level Systems Biology in Mammals. Cell Chemical Biology 23,137-157(2016).
2. Ueda,H.R.et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience 21,61–79(2020).
3. Chung, K. et al. Structural and molecular interrogation of intact biological systems. Nature 497, 332–337(2013).
4. Park, Y.G. et al. Protection of tissue physicochemical properties using polyfunctional crosslinkers. Nature Biotechnology 37, 73–83(2018).

