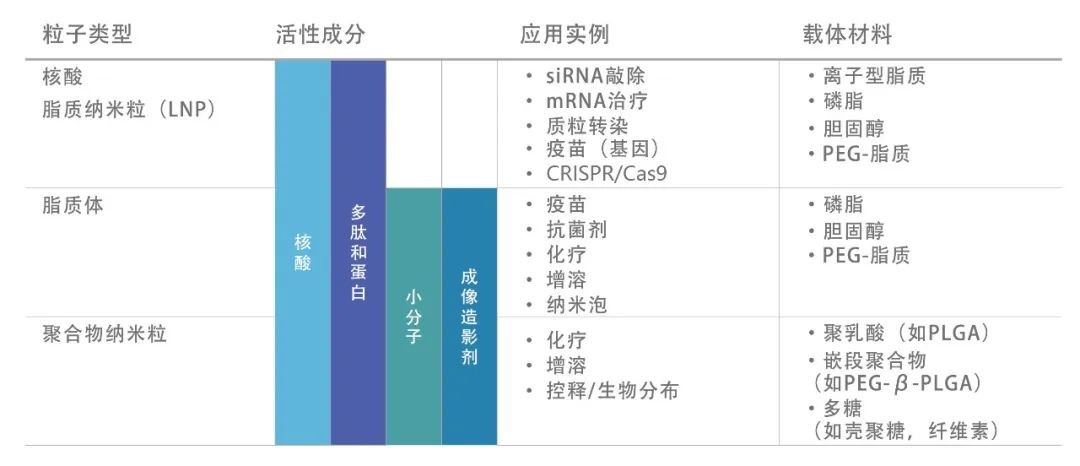
近年来,核酸脂质纳米粒(Lipid nanoparticle,LNP)已成为一种常用的核酸药物递送系统,可有效包裹、保护和递送多种核酸(如mRNA、siRNA、pDNA等)进入细胞,避免核酸被核酸酶降解,并在到达溶酶体前将核酸释放到细胞质发挥相应的作用。LNP拥有诸多优势,如包封率高、细胞转染率高、组织穿透能力强以及低细胞毒性和免疫原性。为了得到均一、稳定的LNP,微流控技术是目前较为主流的方法。本文主要为大家介绍微流控技术制备核酸脂质纳米粒的基本原理。
微流控技术是一种通过几十至几百微米的微通道结构,处理、加工或操控微小流体的技术。微流控技术通过微流控设备精确控制流体流速、设计一定形状的微通道及程序化混合工艺,精确合成核酸脂质纳米粒。该方法制备条件温和,速度快,易于生产放大,其合成的纳米粒的形貌、结构、粒径分布均一,批次间重复可控。通过微流控技术制备核酸脂质纳米粒的核心原理主要有两方面:层流效应及自组装反应。
层流是流体作层状流动的状态,其质点沿着与管轴平行的方向作平滑直线运动。雷诺数(Reynolds number, Re)是用来表征流体流动情况的无量纲数,由英国物理学家奥斯本·雷诺(Osborne Reynolds)首次提出。利用雷诺数可区分流体的流动状态(层流或湍流),也可用来确定物体在流体中流动所受到的阻力。雷诺数的计算公式为:
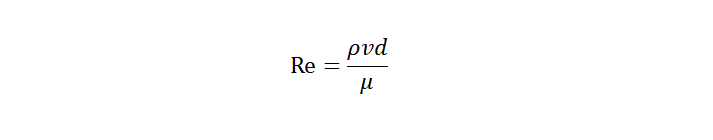
其中,ρ是流体密度,v是流体流速,d是管道直径,μ是流体的动力粘度。
在管流中,当Re小于2300时,流动为层流,黏性力的影响远大于惯性力,使得其流体动力学的性质可预测。当Re等于2300~4000时,流动为过渡状态。当Re大于4000时的,流动为湍流,惯性力占主要地位。
举例来说,无水乙醇在25℃,300 μm的微通道中以12 mL/min的流速进行流动,ρ乙醇=785 kg/m3;μ乙醇=0.001096 Pa.s
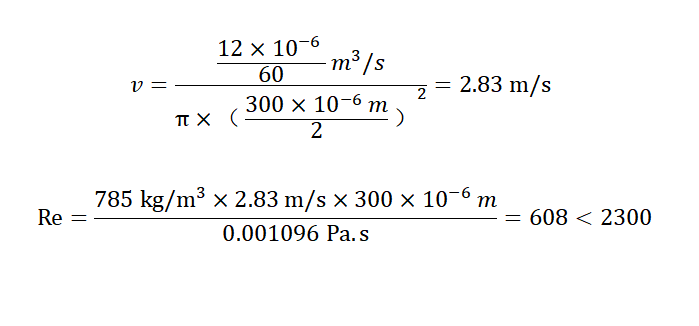
可以判定该条件下,无水乙醇的流动状态为层流。
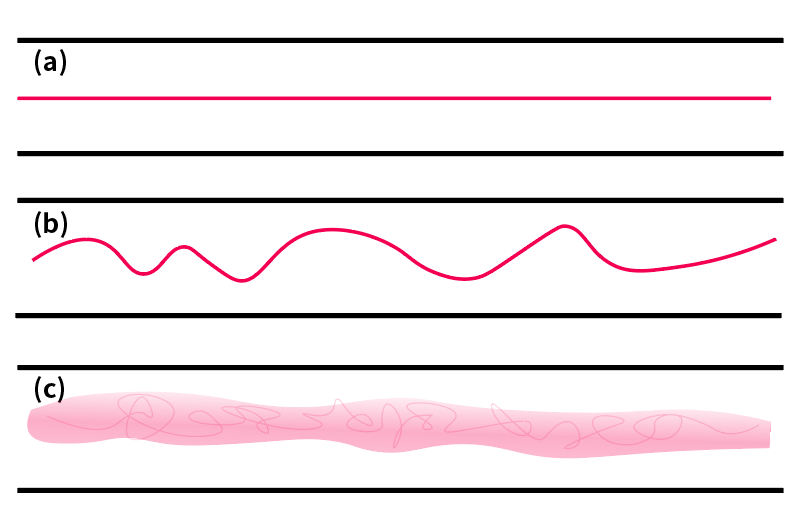
图1 管道中流体状态
((a)层流:染料是通过分子扩散与主流混合;(b)过渡状态:染料条纹为波浪状,但主流仍为层流;(c)湍流:染料条纹不稳定的改变方向,并且由于速度波动,染料与主流混合)
自组装(Self-assembly)反应是指脂质分子在非共价键的相互作用下,自发组织、聚集形成稳定且具有一定几何外观的有序结构的过程。典型的核酸脂质纳米粒主要由四种脂质组成:可电离的阳离子脂质、辅助性脂质、PEG脂质以及胆固醇(图2)。通常将脂质和核酸分别溶解于无水乙醇(有机相)和酸性缓冲液,如0.1 mol/L pH4.0的柠檬酸缓冲液(水相)中。然后,水相、有机相以一定的流速比(如3:1),在微流控纳米药物制备系统中混合,触发自组装反应,形成核酸脂质纳米粒。
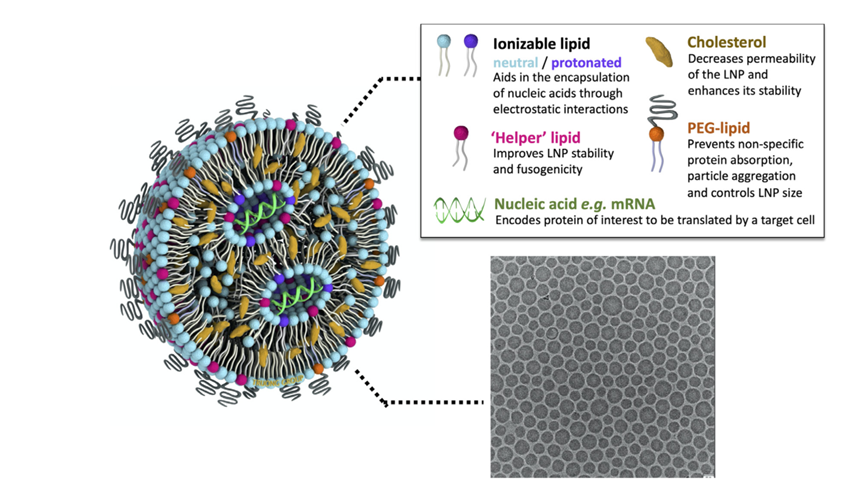
图2 核酸脂质纳米粒示意图
阳离子脂质的结构一般分为三部分:可电离氨基的亲水头基、连接键和疏水尾部(图4)。阳离子脂质的亲水氨基头部在酸性缓冲体系中,被质子化呈正电。当水相与有机相接触时,正电的阳离子脂质和核酸中大量的负电磷酸根,通过静电相互作用结合,从而将核酸封装在LNP内。
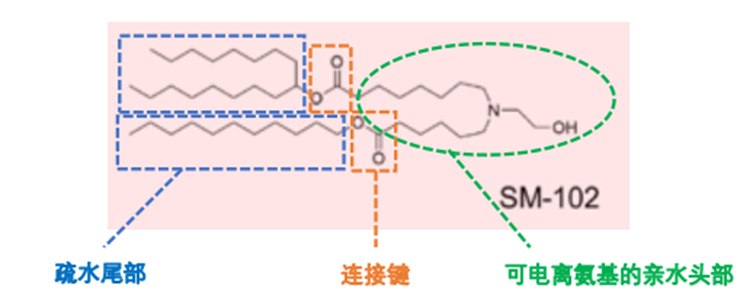
图3 阳离子脂质化学结构示意图
辅助性脂质又称中性脂质,含有亲水基团和疏水基团,当与水相接触时,辅助性脂质及阳离子脂质的疏水基团聚集在一起,而亲水基团伸向水部,发生自组装反应,形成脂质双子层。
PEG脂质是一种两亲性大分子化合物,由疏水头部和PEG亲水尾部构成。当与水相接触时,其疏水头部与辅助性脂质、阳离子脂质的疏水基团聚集在一起。PEG长链由于亲水性和大体积,主要位于LNP的外壳上,为LNP提供了一个外部聚合层,以阻止血清蛋白吸附和单核吞噬细胞系统的摄取,从而延长了体内的循环时间。PEG长链还可以增大LNP的空间位阻,防止纳米颗粒团聚,PEG脂质的含量对LNP的大小也有重要影响。此外,可以对PEG脂质进行靶向修饰,如与配体或生物大分子偶联,实现LNP的靶向递送。
胆固醇通过填充磷脂间的空隙来调节膜的流动性,当与相变温度低的磷脂结合时,可降低膜流动性,增加双层膜的厚度;当与相变温度高的脂质结合时,能够提高膜流动性并使双层膜变窄。此外,胆固醇的加入可以调节膜的完整性和硬度,减少LNP中药物的渗漏,对LNP的转染效率有显著影响。
脂质成分及组成对LNP的粒径、PDI、包封率、稳定性、转染效力和安全性等起着重要作用。更多脂质成分作用,可以查看往期推文具体介绍:脂质纳米颗粒中各成分的作用
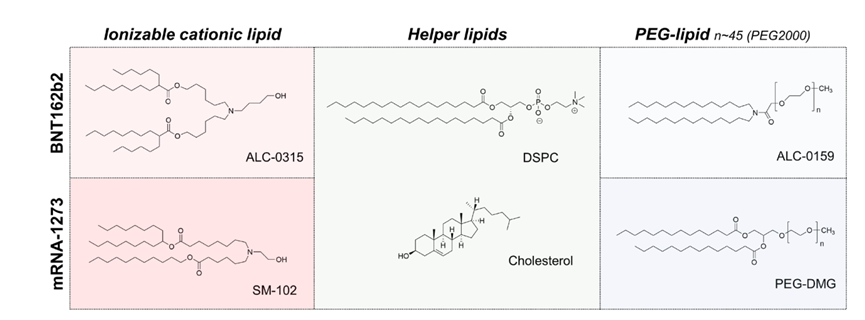
图4 核酸脂质纳米粒成分组成
微流控纳米药物制备系统的核心是微流控芯片,是实现水相、有机相层流效应及控制两相中的有效成分发生自组装反应的场所。微流控通道的体积极小,通过微流控设备精准调控两相液体的流速,可使两相液体以层流的形式,在极小的相界面快速发生自组装反应,反应时间通常在3 ms以内。微流控芯片就像一个微量定量的精准反应器,通过对流体的控制和加剧混合来迅速得到大小均一、重复性好的脂质纳米粒。
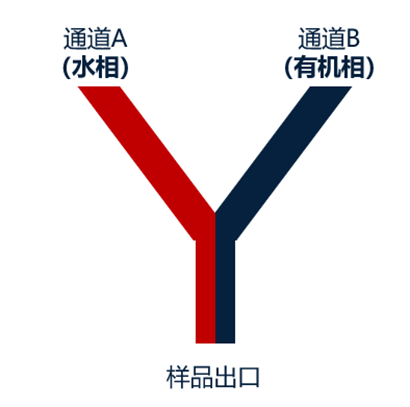
图5 微流控反应示意图
铭汰的微流控芯片采用的是圆环形芯片设计,通过特殊设计的圆环,实现液体多次分流并多次以层流的形式发生自组装反应,加快反应速度,易于形成粒径分布均一可控,重复性好的纳米颗粒。另外,圆环形的芯片设计,方便芯片的清洗,可增大芯片的重复使用次数。同时,铭汰全产品线微流控设备,采用相同的芯片核心结构设计,有利于实现脂质纳米粒合成放大前后效果一致。
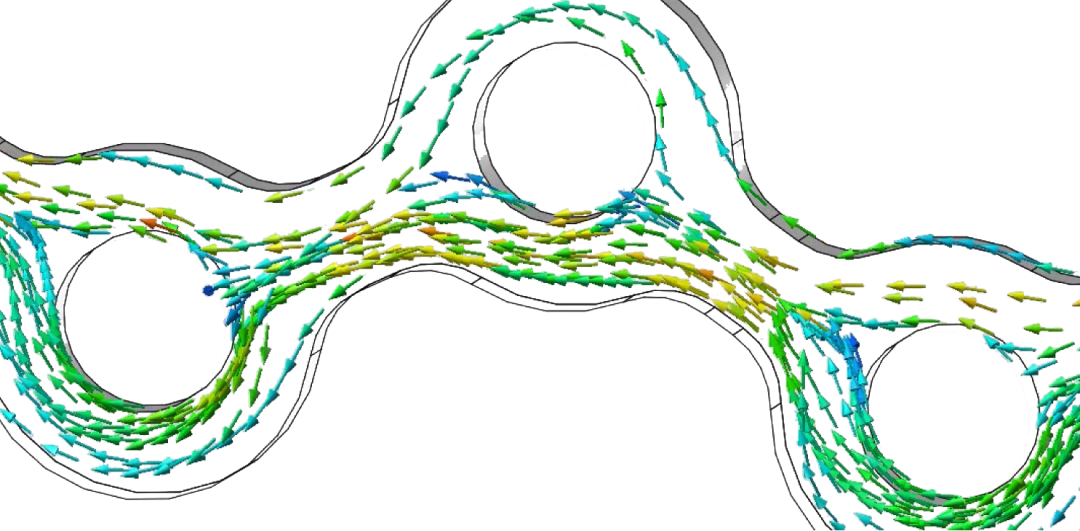
图6 圆环形微流控芯片反应示意图
小结:
通过以上的介绍,相信大家对于微流控技术制备核酸脂质纳米粒的原理已经有了比较清晰的了解。通过精密的微流控设备及微流控芯片,一方面,实现两相液体的层流效应;另一方面,控制有效成分在相界面间的自组装反应。
铭汰提供微流控纳米药物制备全系列产品,可以为客户提供一站式的解决方案。
纳米药物制备系统:
-09-09-5bd73dad-5048-447c-b29d-5ae61b93ca54-ca6b9802-2f32-4493-9f69-4c9a057df651.jpg)
应用文献:
Pilkington Emily H,Suys Estelle J A,Trevaskis Natalie L et al. From influenza to COVID-19: Lipid nanoparticle mRNA vaccines at the frontiers of infectious diseases.[J] .Acta Biomater, 2021, 131: 16-40.
Schoenmaker Linde,Witzigmann Dominik,Kulkarni Jayesh A et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability.[J] .Int J Pharm, 2021, 601: 120586.


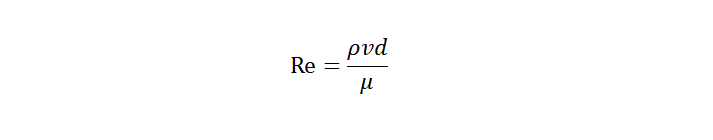
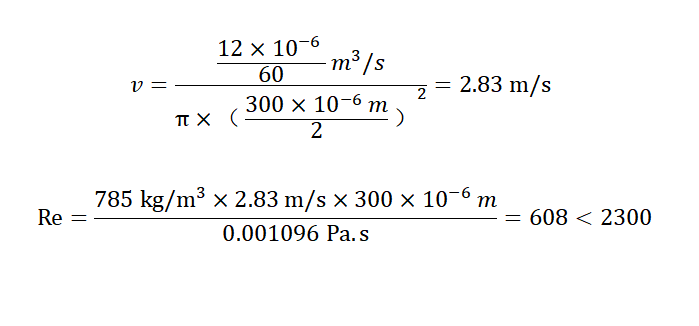






-09-09-5bd73dad-5048-447c-b29d-5ae61b93ca54-ca6b9802-2f32-4493-9f69-4c9a057df651.jpg)