自新冠mRNA疫苗成功上市以来,脂质纳米粒(Lipid nanoparticle,LNP)已成为mRNA、siRNA、pDNA等核酸的优先递送载体,广泛用于mRNA疫苗及治疗。微流控技术是目前制备核酸脂质纳米粒常用的技术,包封率则是评价其制备效果的重要指标之一,下面就为大家介绍使用RiboGreen测定RNA-LNP包封率的方法。
1 RiboGreen检测RNA-LNP包封率的原理
1.1RNA-LNP包封率(Encapsulationefficiency,EE):包裹在脂质纳米粒内部的RNA占RNA-LNP溶液中全部RNA的比例。
1.2 RiboGreen检测RNA原理:RiboGreen是一种用于定量检测溶液中RNA含量的超敏感荧光核酸染料,当RiboGreen荧光染料处于溶液状态时,几乎没有荧光活性,与RNA结合时,其荧光活性将增加1000倍。RiboGreen-RNA复合物的荧光激发波长约500nm,发射波长约525nm,通过酶标仪,建立已知浓度RNA的标准曲线,即可得到样品RNA浓度。
1.3 RiboGreen检测包封率原理:分别测定LNP-RNA溶液中游离RNA浓度,以及用Triton-100破坏LNP结构后,溶液中全部的RNA浓度,两者的差值就是包封在LNP内部的RNA浓度。通过以下公式即可计算得到包封率结果。
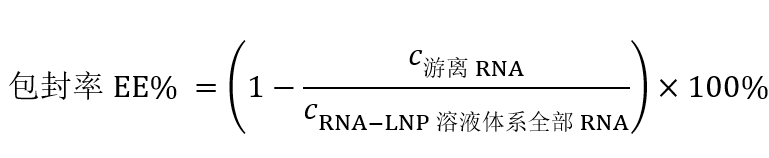
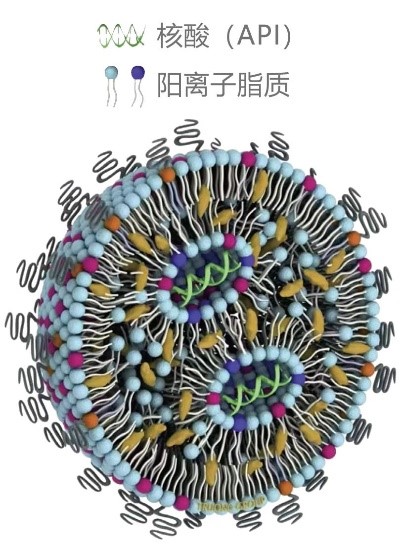
图1核酸脂质纳米颗粒的示意图
2操作要点
2.1制备Buffer
1X TE Buffer:使用试剂盒中20X TE Buffer稀释。
2% Triton-TE buffer:使用Triton-100与1X TE buffer以体积比1:50配制。
2.2添加RNA-LNP样品至全黑96孔板
根据制备时RNA的量,可以大致计算需要稀释的倍数。例如,已知 mRNA的原始质量或浓度,使用铭汰MicroFlow S进行RNA-LNP合成,根据稀释、超滤等处理后的最终体积,即可估算大致总RNA浓度。同时,假设90%的包封率,即可估算游离RNA浓度。然后根据标曲的最高浓度计算需要稀释的大致倍数。
这样我们就可以使用1X TE buffer将RNA-LNP稀释适合倍数以检测LNP外游离RNA浓度,使用2% Triton-TE buffer将RNA-LNP稀释适合倍数以检测总RNA浓度,建议每项检测至少两个不同稀释倍数。
最后,分别移取100 μL稀释后的样本,添加到全黑96孔板。
-4aa2e23f-c604-4f1f-969c-2597552c2a5d.jpg)
-f7db0676-2e86-4cd1-bdb6-5e6953ad162b.jpg)
-d1bddc69-4bee-4900-83ff-3bae4a774508.jpg)
2.3标样添加
一般直接使用试剂盒中100 μg/mL的RNA标样,也可以使用与待测样本类似的RNA标样来建立标准曲线。可以先用1X TE buffer将原始标样稀释到工作浓度4 μg/mL,然后参考表1的体积比,配制为一定浓度梯度的标样。分别移取各浓度的标样100 μL,添加到全黑96孔板中。
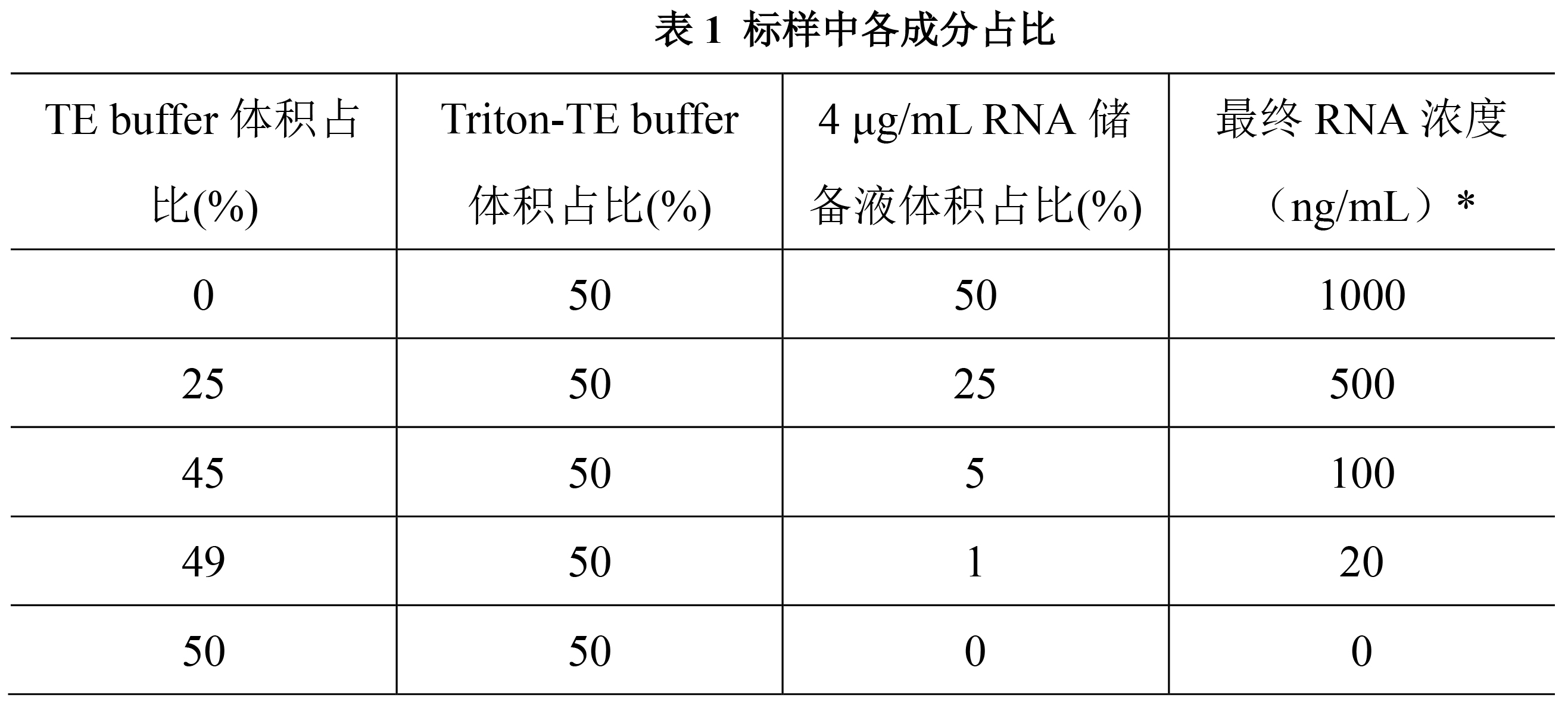
注:*最终RNA浓度考虑了步骤2.4添加RiboGreen染料后的浓度
当RNA-LNP样品及特定浓度的标样添加到96孔板后,需要在37℃下避光孵育10 min,以使RNA-LNP在Triton buffer中充分裂解。
2.4 RiboGreen染料添加
把试剂盒中RiboGreen试剂,使用1X TE Buffer按照1:100的比例稀释,例如需要2000 μL RiboGreen染料,可将20 μL的RiboGreen试剂添加到1980 μL的1X TE Buffer中。然后各取100 μL加入到已经加有样品的96孔板中,37℃下避光孵育5min。

图2 样品添加
2.5酶标仪检测
打开酶标仪,选择荧光模式,激发光485nm,发射光528nm,读数,记录数据。
2.6数据处理及分析
将每个样本测得的荧光值减去空白荧光值,即可得到实际荧光值。根据标样的荧光值和浓度梯度,绘制标准曲线,得到回归方程。把样品荧光值代入回归方程,乘以稀释倍数,即可得到样本的RNA浓度。根据1.3中包封率公式计算得到包封率结果。
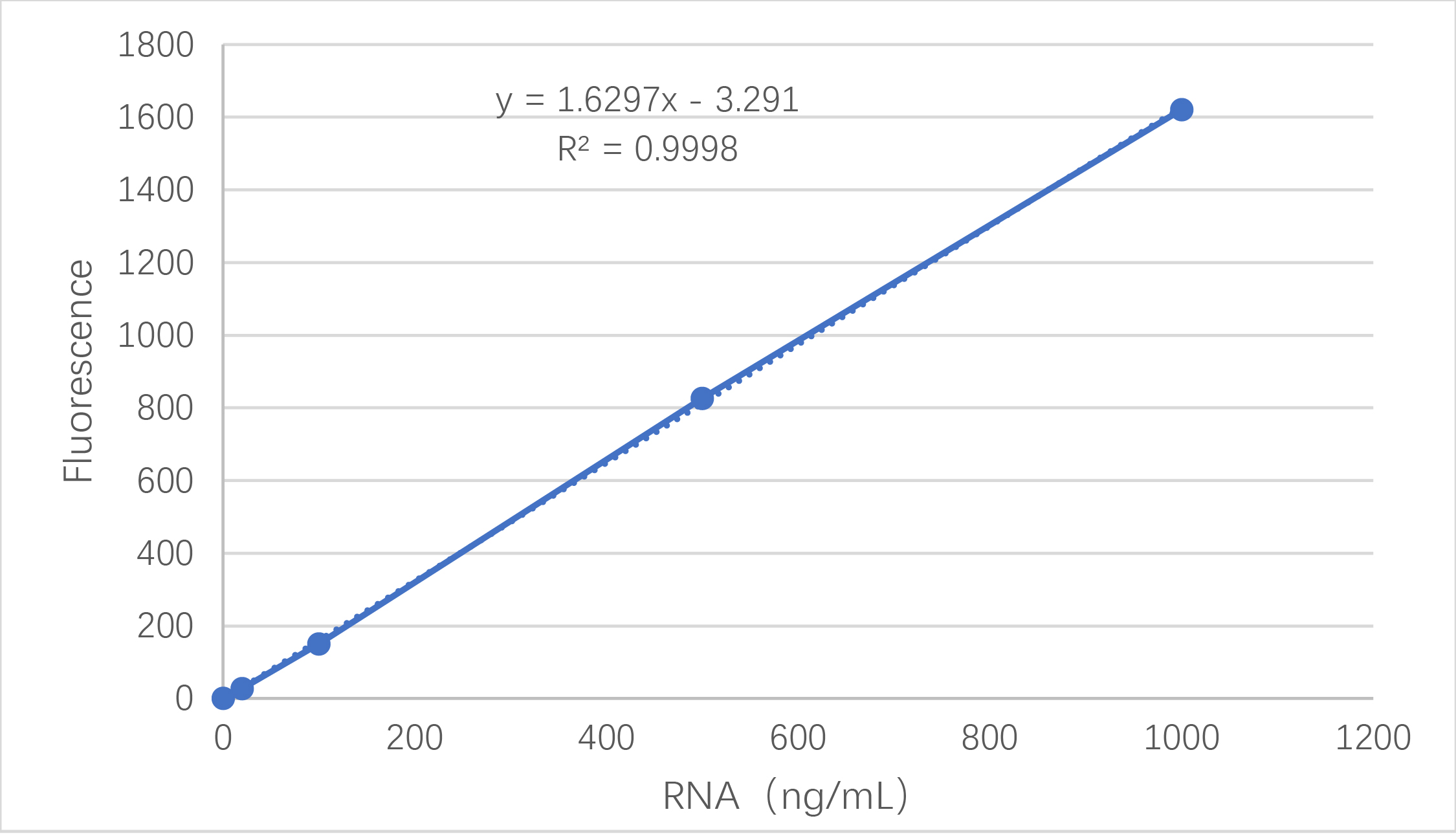
图3 标准曲线
3 小结
准确的包封率测定对于评价RNA-LNP的包封效果至关重要,影响着后续细胞实验和动物实验的开展。RNA-LNP包封率测定一般使用商业化的试剂盒,虽然操作环节较多,但只要细心规范,操作起来也并不难,相信大家可以得到准确的实验结果。
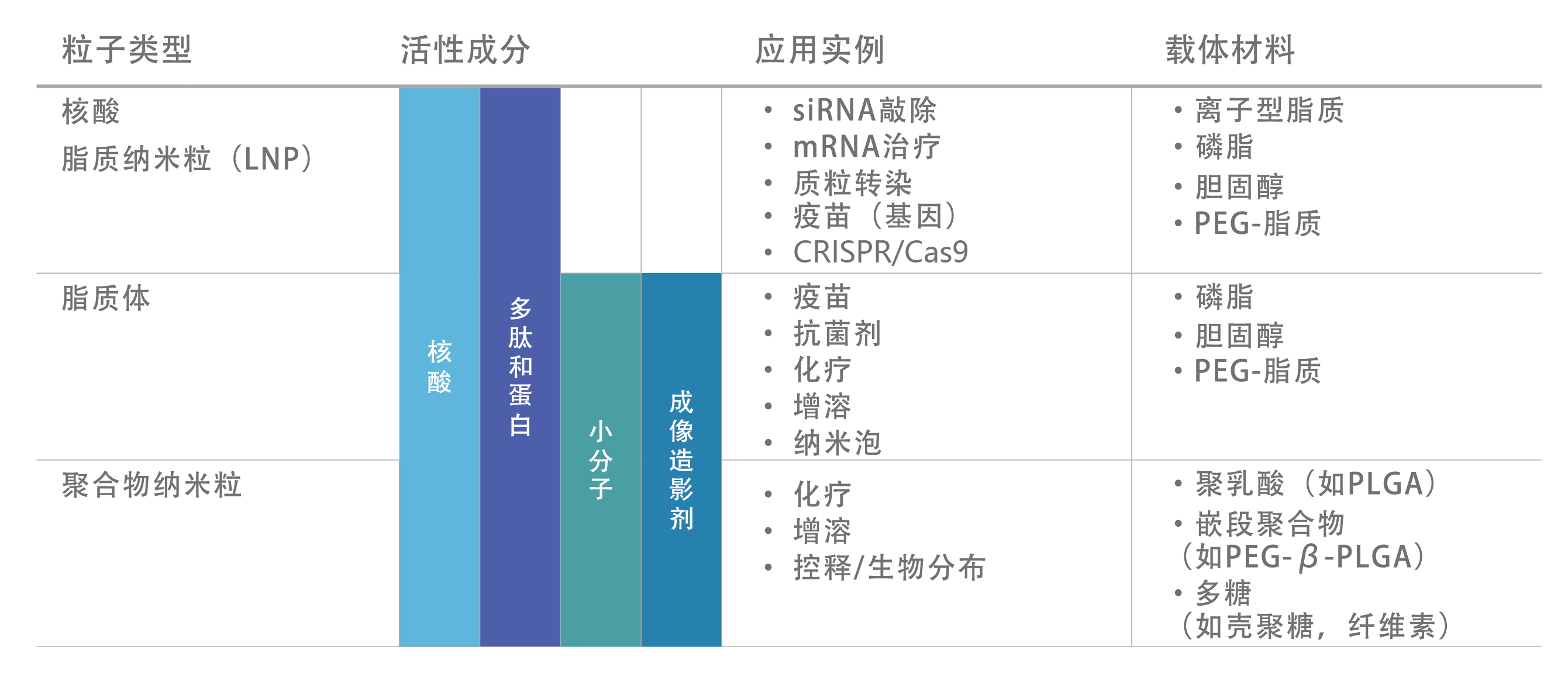
纳米药物制备系统

应用范围:
往期回顾:
●核酸脂质纳米粒科普——氮磷比计算
● 核酸脂质纳米粒科普——后处理
● 核酸脂质纳米粒科普——超滤管规格




-4aa2e23f-c604-4f1f-969c-2597552c2a5d.jpg)
-f7db0676-2e86-4cd1-bdb6-5e6953ad162b.jpg)
-d1bddc69-4bee-4900-83ff-3bae4a774508.jpg)




