谈到CRISPR-Cas9,大家一定非常熟悉,这种新型的基因治疗方法自打问世以来就广受研究者们的推崇,凭借其较好的敲除效果,风靡科研界。但一直由于其较低的基因编辑效率以及现有递送系统的毒性,限制了其在癌症治疗领域的应用。
大多数基因编辑的体内研究都依赖于腺病毒载体进行CRISPR成分的递送。但是,腺病毒载体受到其低包封效率、高剂量肝毒性、易引起免疫反应和缺乏细胞靶向性等因素的限制,且多是作用在肝脏相关的疾病。
近来,以色列的研究者们通过非病毒载体Lipid nanoparticles (LNPs),实现对CRISPR成分的高效递送。并分别在两种侵袭性和不可治愈的癌症模型——胶质母细胞瘤和卵巢癌中展现出了较好的治疗效果。
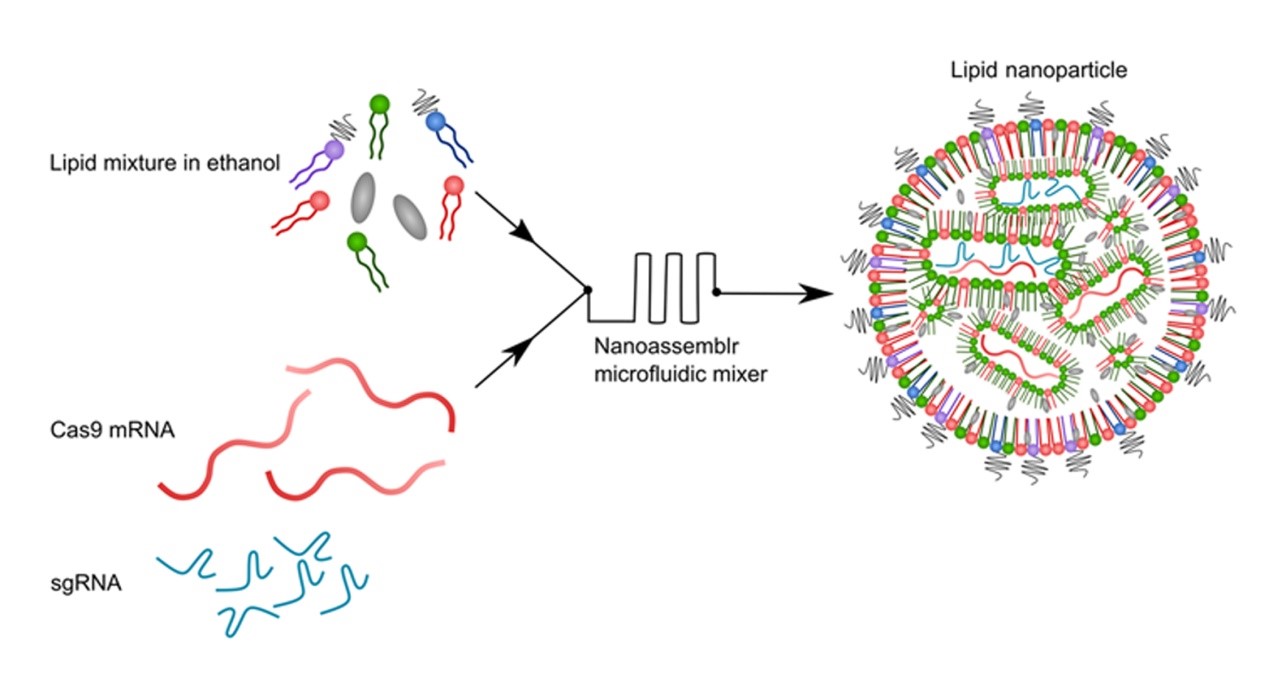
图1. CRISPR LNPs (cLNPs)的制备示意图
该研究中,研究者们将Cas9 mRNA和single-guide RNA (sgRNA)通过NanoAssemblr成功包载在由阳离子磷脂等多种磷脂组分组成的脂质纳米颗粒中,制备得到最终的递送载体CRISPR LNPs (cLNPs),详见图1。并在随后的处方筛选过程中,制备出了一批不同磷脂配方的cLNPs,并且都展现出了良好的粒径、PDI以及包封效果。粒径普遍分布在80 nm,PDI低于0.1。通过体外细胞水平的基因敲除效果从中选取了适合的磷脂处方进行后续的研究,详见图2。

图2.多种磷脂处方的筛选。C.不同处方的cLNPs的粒径、PDI、电位;D.不同处方的cLNPs的Cas9 mRNA和sgRNA包封率;E.不同处方的cLNPs在HEK-293细胞中的基因敲除效果
研究者们随后在大量的细胞实验上进一步验证了cLNPs的基因编辑效果,并通过该基因编辑产生了相应的细胞凋亡反应,使得体外培养的胶质母细胞瘤细胞和卵巢癌细胞的增殖受到抑制。如图3所示。
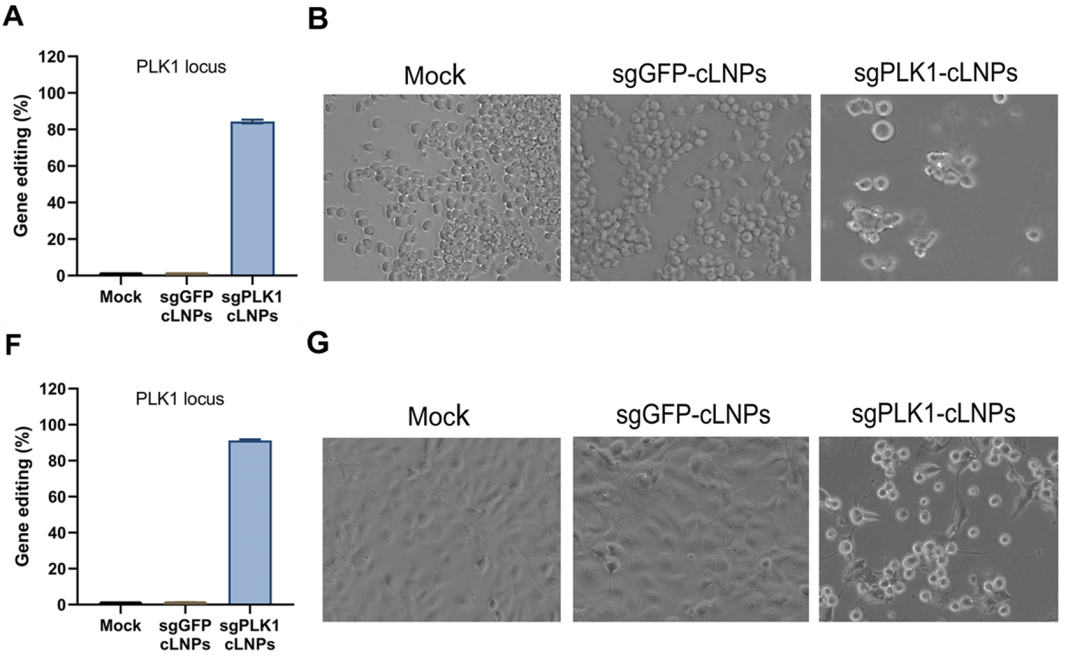
图3.细胞水平上的基因编辑(A、F)和细胞凋亡(B、G)效果
最后在两种癌症模型小鼠——胶质母细胞瘤和卵巢癌上也看到了很好的治疗效果。在一次给药后,胶质母细胞瘤的生长就受到了明显的抑制,小鼠的生存期显著延长。而经过靶向修饰后的cLNPs在非弥散性的肿瘤模型卵巢癌上实现了很好的肿瘤靶向,并且经过两次给药后也展现出了很好的肿瘤抑制效果。详见图4。

图4.动物水平上的肿瘤抑制效果。F.胶质母细胞瘤模型;G.卵巢癌模型
总之,这篇研究成果成功通过制备良好的LNPs实现对CRISPR-Cas9成分的高效递送,并在胶质母细胞瘤和卵巢癌上展现出了很好的治疗效果。该研究为利用基因编辑技术作为治疗各种疾病的新方式开辟了新的途径,也为CRISPR-Cas9相关技术早日推上临床提供了可能。
参考文献:Rosenblum et al., Sci.Adv. 2020; 6 : eabc9450





