日本理化学研究所的一支科研团队在Nature Communications上发表了一篇题为Versatile whole-organ/body staining and imaging based on electrolyte-gel properties of biological tissues 关于狨猴透明化、染色和成像技术的文章。全器官/全身三维染色和成像一直是组织学领域长期面临的挑战。该团队首先对整个组织进行了透明化,再用优化后的三维组织染色对特定细胞进行染色和标记,再进行三维成像观察特定类型的细胞。该团队的透明化方法稳定、简单、可重复和安全;染色方法可以标记成年小鼠整脑、成年狨猴半脑、1 cm3左右的人类小脑组织块、整个幼年狨猴等,该方法稳定,具有实际可行的染色剂和抗体,且无需使用专用设备;然后使用光片显微镜进行全器官三维成像再对数据进行计算分析。该方法为多细胞系统的器官和生物体规模的组织学分析做出了贡献。

通常大组织三维染色时会面临抗体或染料很难进入组织的问题,该团队为了寻找理想的免疫染色标记方法,对生物组织的理化特性进行了详细分析后发现,去脂后的生物组织相当于一种主要由交联多肽组成的电解质凝胶,且化学性质与人造蛋白凝胶非常相似,具有网状/网络结构(由PFA固定引入),不溶解在介质中,在各种化学条件下表现出反复的膨胀和收缩。利用这一特性,该团队使用了人工凝胶来模拟生物组织,定量检测各种抗体标记及染色条件,成功建立了理想的通用型免疫染色和标记方法。通过化学添加剂(如 Quadrol 和尿素)调节染料/抗体与组织之间的相互作用;使用含有500 mM NaCl缓冲液的ScaleCUBIC-1作为核染色缓冲液;将200 mM NaCl和10% Triton X-100应用于免疫染色缓冲液;选择适当的温度、离子强度、洗涤剂浓度和抗体浓度,以及有限的组织消化。
该团队使用优化的透明化技术,配合光片显微镜三维成像(分辨率接近各向同性,8.3 μm × 8.3 μm × 9 μm),成功对小鼠的整个大脑和肾脏、狨猴的半个大脑和一平方厘米的人脑组织进行了染色和成像。此外,还用核染料对一只幼年狨猴进行了全身三维成像。在三维染色和透明样品中,细胞到亚细胞的结构被合理保留。该方法适用于各种抗体和染料(约30种),可实现多色多模态完整器官染色,支持完整器官的单细胞水平的神经回路与功能分析、物种间器官水平的组织学比较等。例如,该团队发现小鼠和狨猴大脑中血管的总体分布模式类似,单小脑中的胶质细胞分布不同,故作者推测不同物种小脑的结构差异可能是胶质细胞模式的差异导致的。
该团队的研究为大组织三维染色提供了一种很好的方法和思路,也为组化方法的发展提供了一个范式转变,例如基于组织特性构建染色方案。这些结果有助于在器官和全身范围内系统地分析生物的结构和功能,并提高3D临床病理学检查的诊断准确性和客观性。研究作者也希望未来继续增加适用的抗体和染色剂数量,从而应用于发育、癌症、炎症和传染病等更广泛的研究领域。
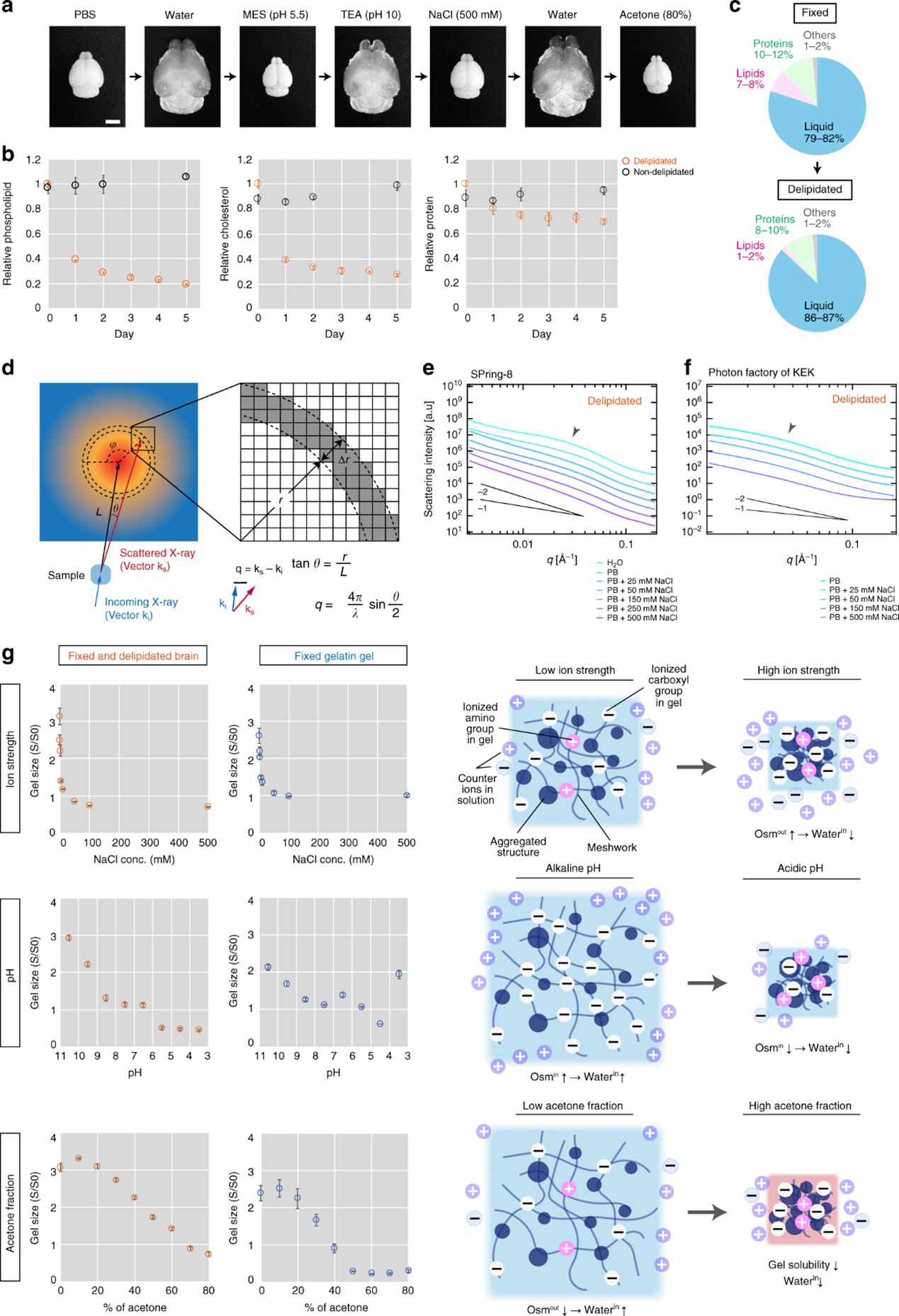
图1. a 用不同化学条件处理的固定和去脂的整个小鼠大脑。MES:2-(氨基酚)乙磺酸,TEA:三乙醇胺。比例尺:5 mm。b 去脂过程中组织内成分的变化。这些值表示与未去脂样品的比值平均值±标准差(n≥3)。c 去脂前后组织成分的变化。d SAXS测量和分析示意图。散射X射线的强度(I)与散射角(θ)之间的关系反映了样品内部的纳米级结构。在二维强度图上以特定角度(φ)[或循环平均数(φ=0–2π)]沿半径(r)计算宽度Δr的I值。根据公式,将散射角(θ)转换为散射矢量q的大小(与内部结构的大小成反比)。L:样品与检测器之间的距离,λ:X射线的波长。e,f 在SPring-8(e)和高能加速器研究机构(KEK)(f)的光子工厂(f)测量的不同NaCl浓度的脑切片的SAXS分析的I-q图。线表示质量分形维数D的斜率。g 去脂组织和固定明胶凝胶的膨胀-收缩曲线。y轴(S/S0)表示凝胶面积的相对值(平均值±SD,n = 3)。
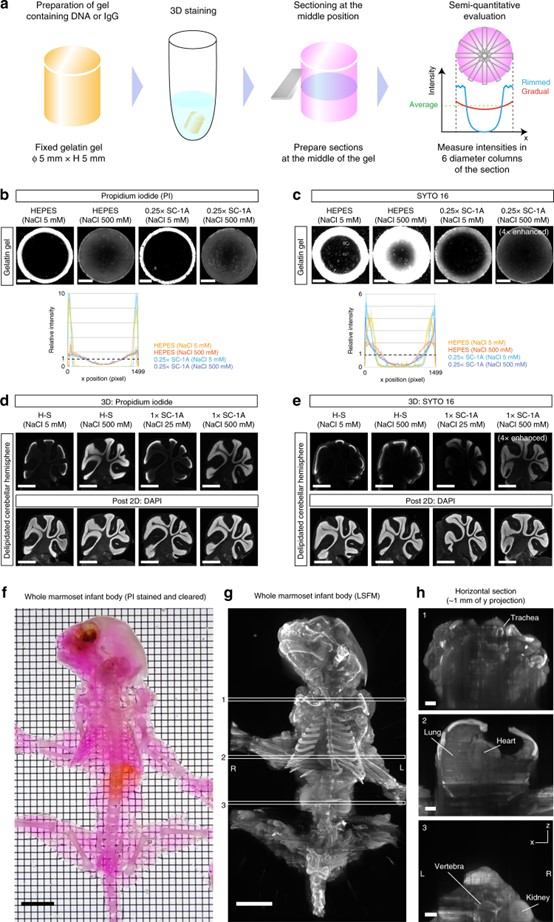
图2. a 替代物测定示意图。使用含有 DNA 或兔免疫球蛋白的圆柱形固定明胶凝胶进行实验评估凝胶内部的三维染色模式(边缘或渐变模式)。b 用PI对含 DNA 的明胶凝胶进行染色的代表性结果,PI是一种电离、疏脂和细胞不渗透的核染料。高浓度的盐调节了凝胶-染色剂的相互作用,从而改善了内部染色模式。比例尺:1 mm。c 含DNA明胶凝胶的SYTO 16染色代表性结果,SYTO 16是一种亲脂性和细胞渗透性核染料。在高浓度盐条件下额外使用ScaleCUBIC-1A(SC-1A)可改善穿透模式,同时降低信号强度(表示为“4 × 增强”)。比例尺:1 mm。b和c中的剖面图显示了a中六个直径区域的平均强度±SD。d,e b和c中的结果通过使用固定和去脂组织(小脑半球)进行重复。三维染色后,对样品进行切片以评估染色剂在组织内的渗透情况。同时对切片用DAPI重新染色,以检查细胞核的可检测性(2D)。比例尺:1 mm。f–h 相互作用调制的三维染色扩大到整个狨猴幼体。f 经过透明和PI染色的狨猴幼体。PI染色在高离子强度条件下进行。比例尺:1 cm。g 使用定制的 LSFM(体素尺寸:10.3 × 10.3 × 100 μm 3)获取的透明化和染色后的全身三维图像。白框表示x–z图像在图中的位置。比例尺:1 cm. h 在g中指定位置的x-z图像。比例尺:2 mm。
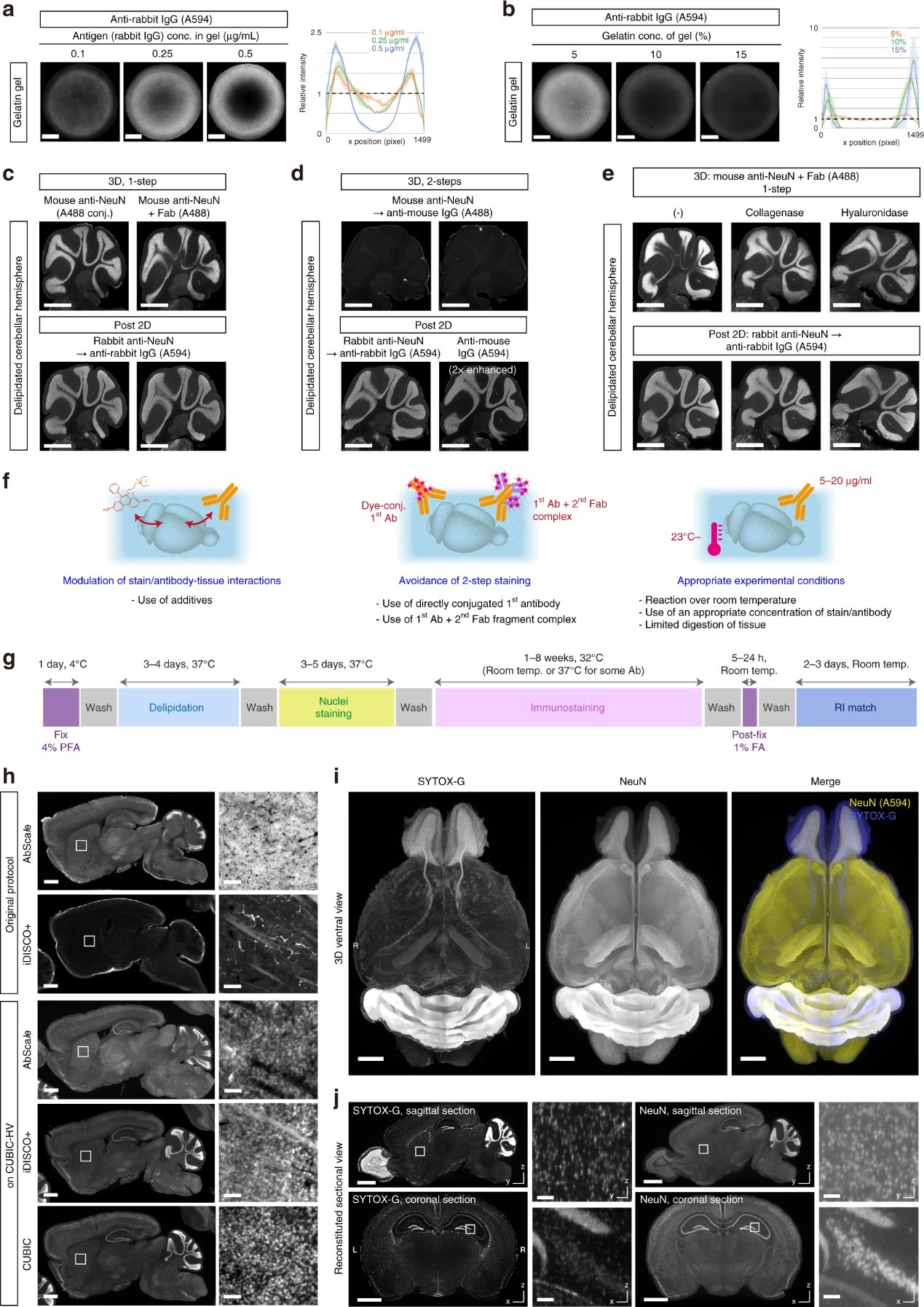
图3. a,b 含rabbit IgG明胶凝胶anti-rabbit secondary IgG (A594)染色的代表性结果。比例尺:1mm。剖面图显示了六个直径区域的平均强度±标准差,如图2a所示。c-e a和b的结果用固定和去脂后的组织重复。c,d 比较了直接使用mouse anti-NeuN-A488或unconjugated anti-NeuN with secondary Fab fragment [3D,c]的一步法程序与常规的一抗后使用二抗的两步法[3D,d]。用A488可视化三维染色结果。染色后,对样品进行切片,先用rabbit anti-NeuN抗体染色,然后再用secondary anti-rabbit IgG (A594)染色,或仅用secondary anti-mouse IgG (A594)染色,分别确认NeuN抗原的可检测性或NeuN一抗的渗透程度。比例尺:1 mm。e 胶原酶或透明质酸酶处理通过类似的染色方法进行测试。比例尺:1 mm。f 高效 三维 染色的基本条件概述。透明化、染色和折射率匹配概述。三维染色方案的比较和修改。用anti-NeuN抗体对成年小鼠半脑进行染色。每张图像中的强度范围均已归一化。比例尺:1 mm(用于整个矢状切片)或 50 μm(用于放大图像)。i 使用定制 LSFM 对成年小鼠大脑进行双色全器官染色和三维成像结果。体素尺寸:8.3 × 8.3 × 9 μm3。使用Imaris重建三维图像。比例尺:2 mm。j i中数据的yz面或xz面图像,显示均匀的染色和几乎各向同性细胞级分辨率的三维成像。使用Fiji/ImageJ得到层切图像。比例尺:2 mm(用于整个图像)或 100 μm(用于放大图像)。
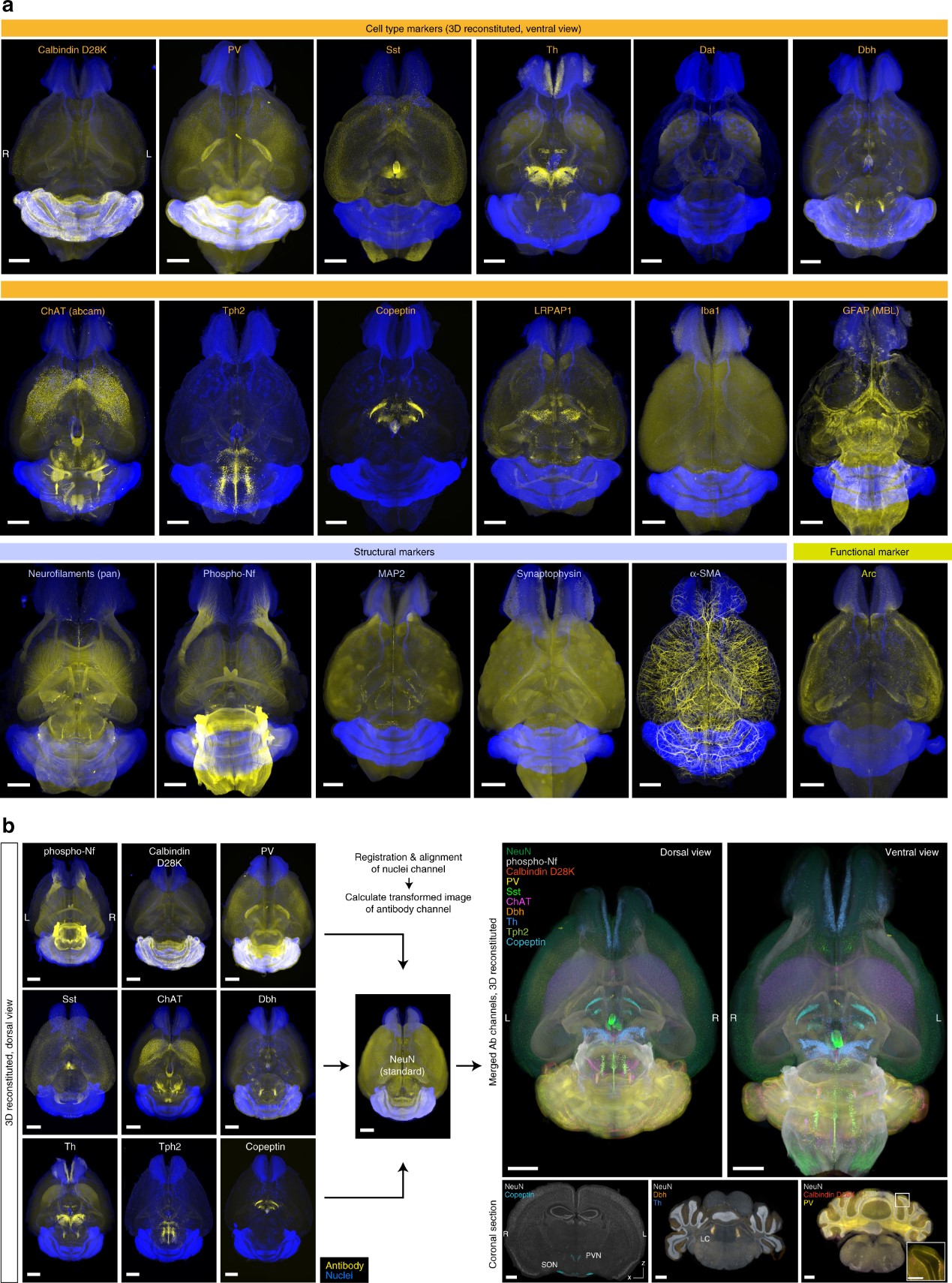
图4. a 使用各种抗体(黄色)和核染色(SYTOX-G 或 BOBO-1,蓝色)进行全脑染色和 LSFM 成像的结果。使用Imaris软件重建数据。体素尺寸 8.3 × 8.3 × 9 μm3。比例尺:2 mm。b 将a中的9组全脑成像数据(分别用磷酸化细胞核因子NF、钙结合蛋白D28K、PV、Sst、ChAT、Dbh、Th、Tph2 或和肽素染色)进行配准,并与通过抗 NeuN 抗体染色和核染色获得的全脑图像进行比对。所有转换后的数据均用Imaris软件合并为伪多靶点全脑抗体染色图像。精确的配准结果由不同数据集中合并的大脑区域表示,例如室旁核(PVN)和视上核(SON)(NeuN+/copeptin+)、脑桥中的蓝斑(LC)(Dbh+/Th+)和小脑中的浦肯野细胞层(calbindin D28K+/PV+)。比例尺:2 mm(全脑)、1 mm(重组冠状切片)、0.5 mm(插图)。
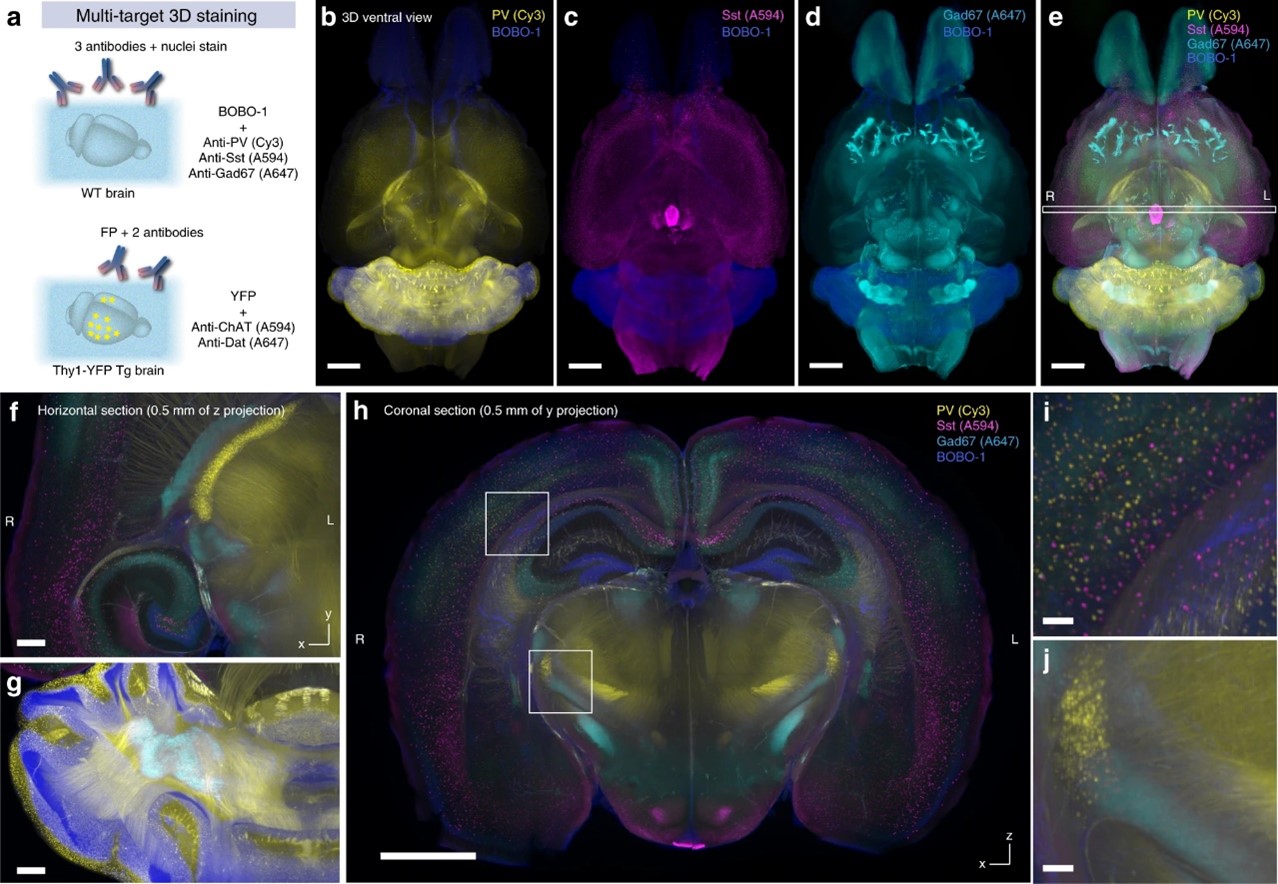
图5. a 多通道和多模态全脑染色和成像的实验示意图,如图5和6所示。b–j BOBO-1、PV(Cy3)、Sst(A594)和Gad67(A647)使用Imaris软件重建的成年小鼠大脑的四通道染色图像。(b-d)BOBO-1通道旁的单个抗体染色通道。体素尺寸8.3 × 8.3 × 9 μm3.比例尺:2 mm。e 四个通道的合并图像。比例尺:2 mm。f,g 代表性切片的局部放大xy面图像。比例尺:0.5 mm。h 在e中指示位置的xz面切片图像。比例尺:2 mm。I,j h中指示位置的局部放大图像。比例尺:0.1 mm。
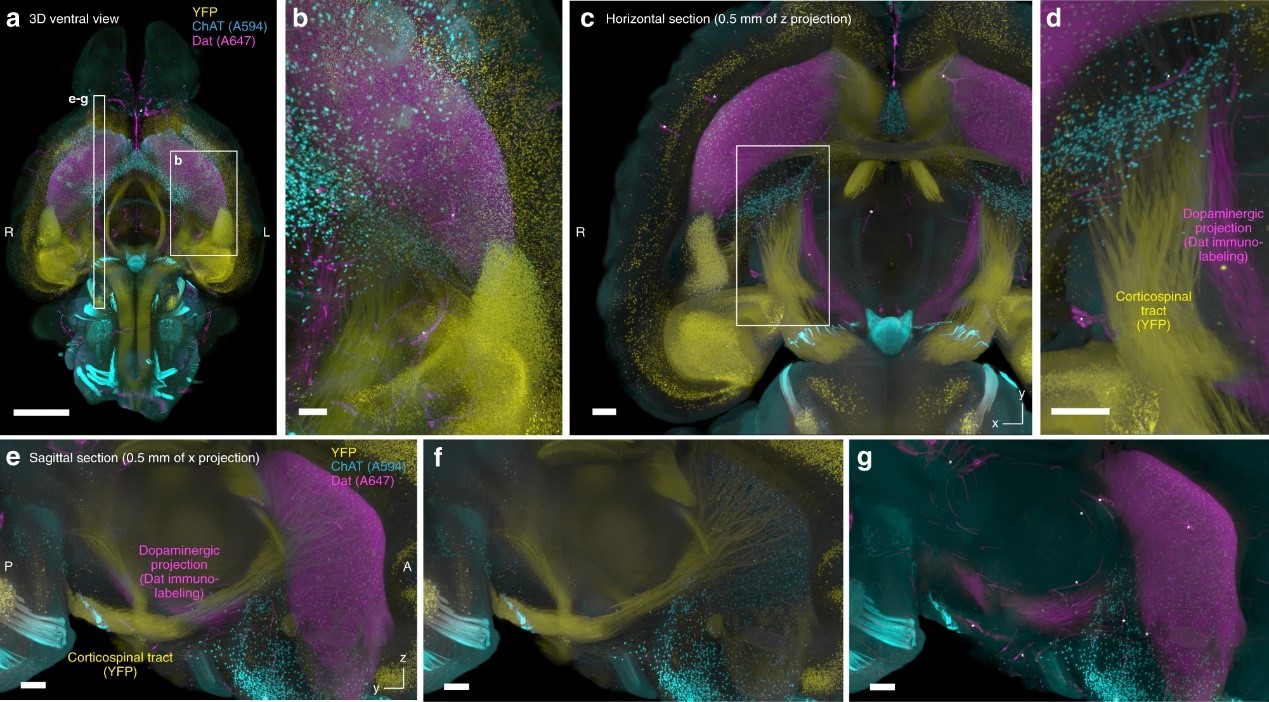
图6. a-g ChAT(A594)和 Dat(A647)染色Thy1-YFP-H Tg成年小鼠整脑的双通道图像。体素尺寸8.3 × 8.3 × 9 μm3。a 三通道的合并图像。比例尺:2 mm。b a中所示位置的局部放大图像。比例尺:0.5 mm。c 代表性层切的水平视图。比例尺:0.5 mm。d c中指示位置的局部放大图像。观察用YFP表达或抗Dat免疫标记标记的邻近投射束。比例尺:0.5 mm。e–g 在a中指示位置yz面层切图。比例尺:0.5 mm。e-g中的星号表示由于样本灌注不足而导致的非特异性血管信号。
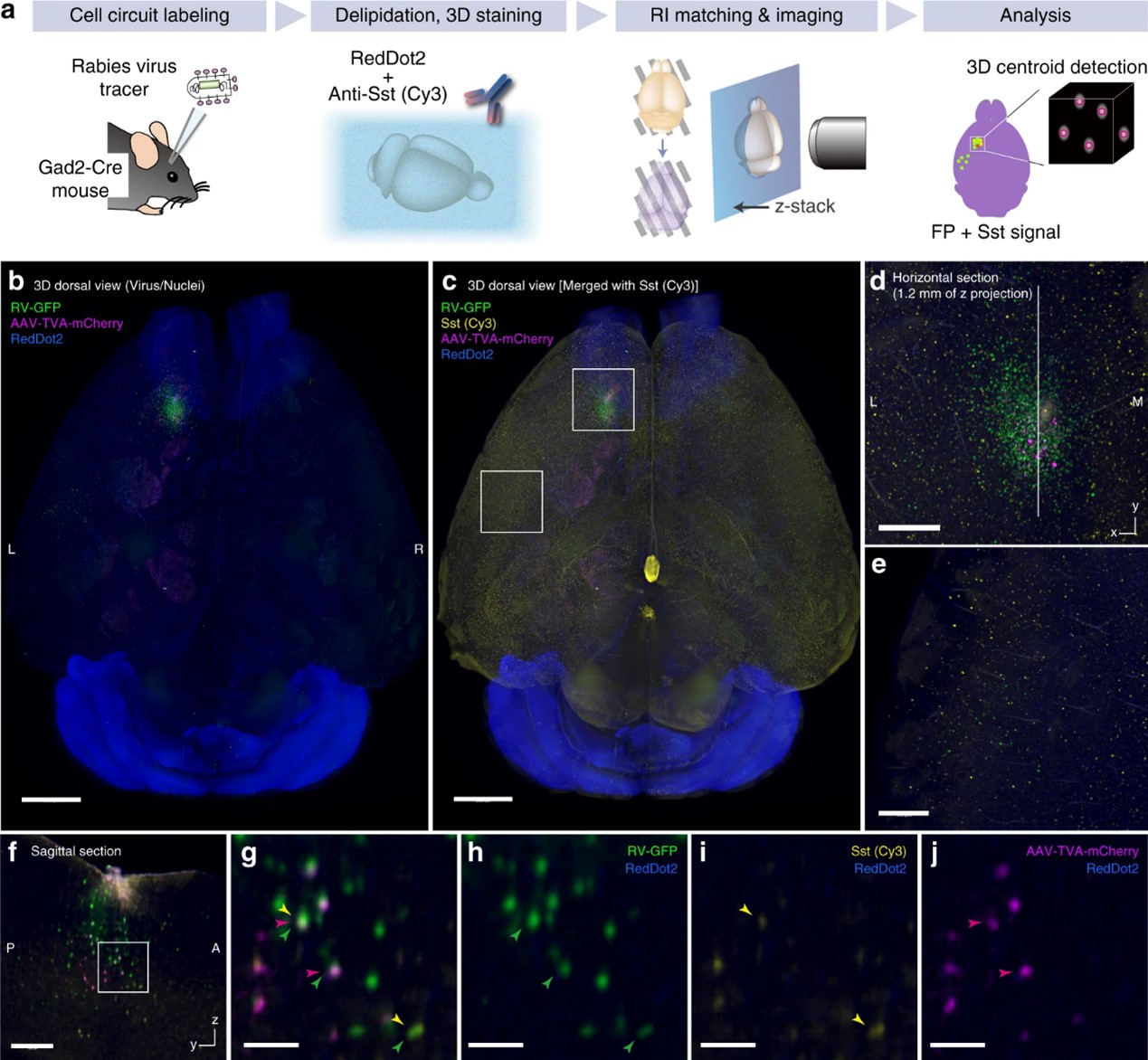
图7. a 全脑狂犬病病毒(RV)细胞型免疫标记示踪实验示意图。b 用Imaris软件重建RV注射Gad2-Cre成年小鼠全脑图像。将TVA-mCherry和RV-GFP注射到大脑皮层的左侧M1区域。体素尺寸8.3 × 8.3 × 9 μm3。比例尺:2 mm。c 抗Sst抗体染色通道与b中的图像合并。比例尺:2 mm。d,e 在 c 中指定位置局部放大的水平层切图,显示局部和同侧皮质间回路中RV标记的神经元。比例尺:0.5 mm. f 在d所示位置的yz面层切图。比例尺:0.5 mm。g-j f中指示位置的裁剪和放大图像。有或没有 Sst 信号的起始神经元(绿色和洋红色)和输入神经元(绿色)可以用单细胞分辨率识别。比例尺:0.1 mm。
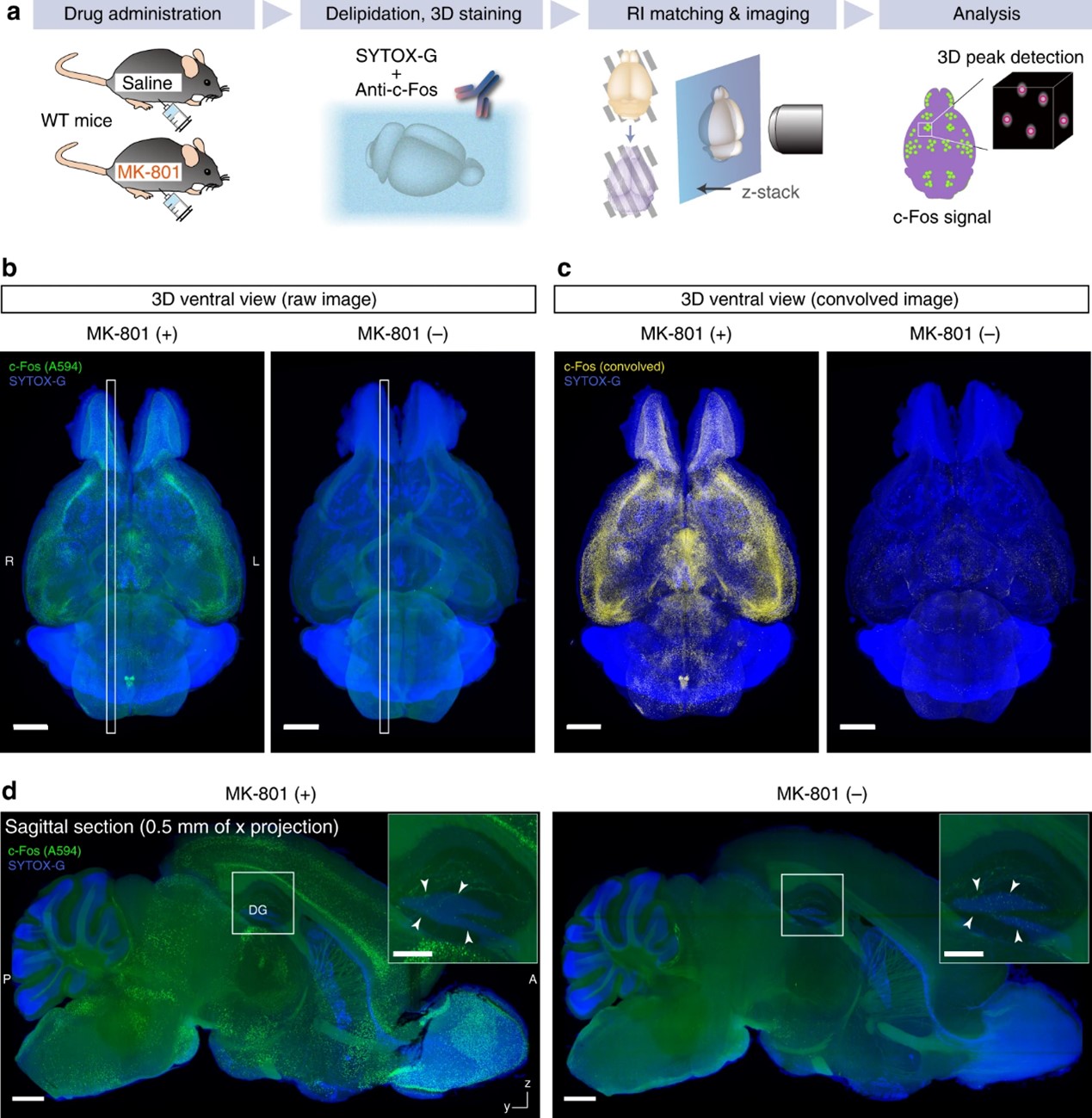
图8. a 不同药理学条件下全脑c-Fos抗体染色的实验示意图。b 是否给予NMDA受体拮抗剂MK-801时,c-Fos免疫标记的成年小鼠全脑图像。图像使用Imaris软件重构。体素尺寸6.5 × 6.5 × 7 μm3。白框表示重建的yz面图像在d中的位置。比例尺:2 mm。c 对b中的图像应用卷积滤波器后生成的图像。比例尺:2 mm。d b中大脑的yz面图像,显示表达 c-Fos 的细胞的均匀标记。齿状回(DG)区域的c-Fos表达细胞在MK-801(-)样品中更为明显(插图中的箭头)。比例尺:1 mm(整个yz面图像)和 0.5 mm(插图)。
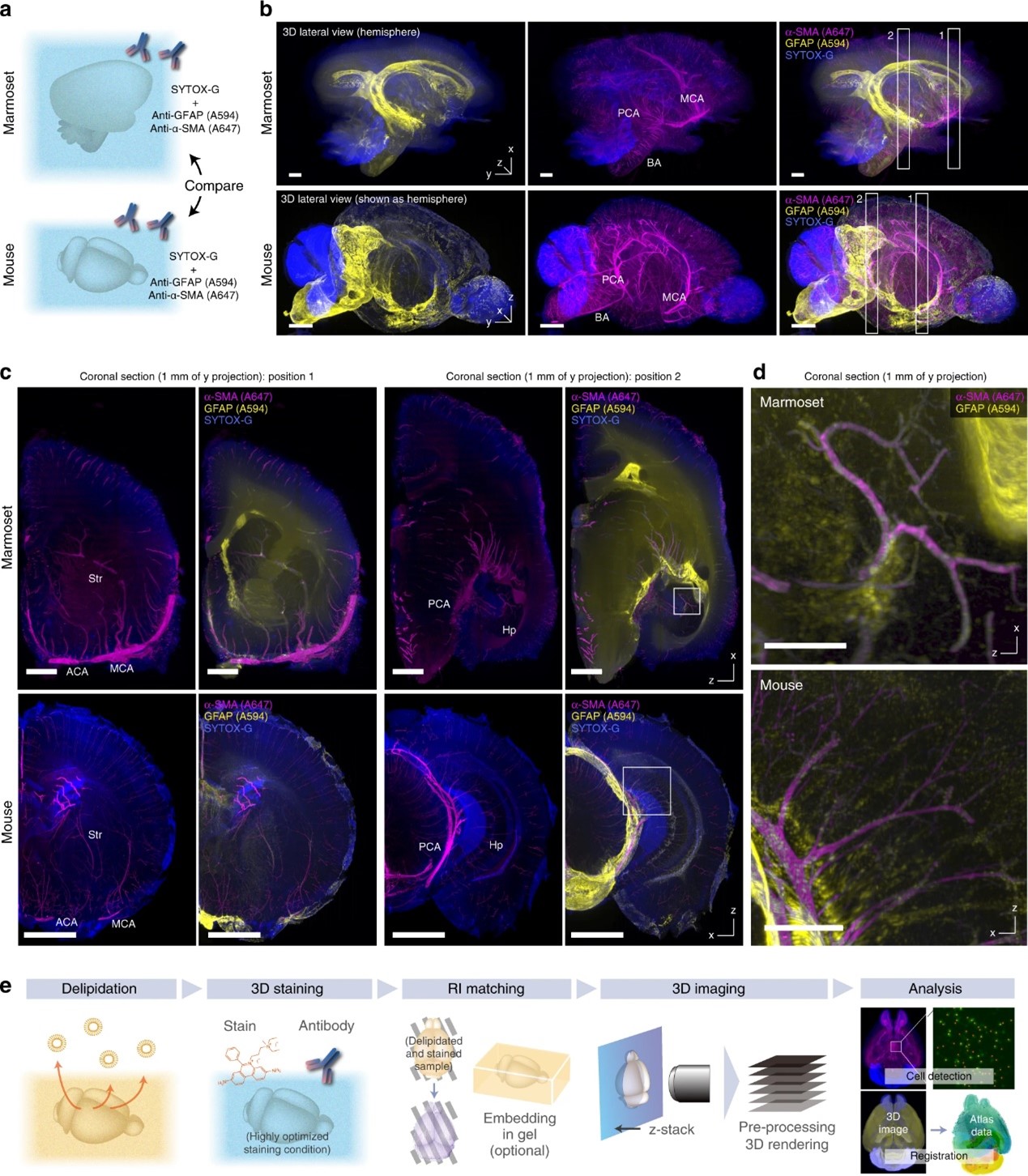
图9. a 啮齿动物与灵长类动物大脑的全器官比较分析的实验示意图。b用SYTOX-G、GFAP(A594)和α-SMA(A647)抗体染色后,比较成年狨猴半脑和成年小鼠整脑(仅展示右半脑)。请注意,不同样品的方向不同。使用Imaris软件重建图像。体素尺寸16.4 × 16.4 × 16 μm3(狨猴脑)和8.3 × 8.3 × 9 μm3(小鼠脑)。比例尺:2 mm。c b中半球图像的xz面层切图,显示相应血管结构和GFAP阳性细胞的分布。由于z-stack图像的体素分辨率几乎是各向同性的,因此可以比较层切的不同方向(狨猴和小鼠样本的z-x和x-z)。比例尺:2 mm。d 在c中指示的位置局部放大图像,显示海马体中血管相关GFAP阳性细胞的相似分布。体素尺寸8.3 × 8.3 × 9 μm3。比例尺:0.5 mm。e 全器官成像和图像分析流程图。
锘海生命科学搭建的一站式服务平台,可为广大客户提供大组织甚至整鼠透明化、免疫染色、平铺光片显微镜3D荧光成像科研服务。欢迎各位感兴趣的老师留言咨询。
Thy1-GFP成年小鼠完整中枢神经系统
分辨率: 2 μm × 2 μm × 5 μm
*使用锘海组织透明化系列试剂盒及锘海LS18平铺光片显微镜进行三维成像。
细节分辨率:0.52 μm × 0.52 μm × 1.4 μm *使用锘海组织透明化系列试剂盒及锘海LS18平铺光片显微镜进行三维成像。
全脑c-Fos神经元三维成像与精准映射
分辨率:3.3 μm × 3.3 μm × 7 μm
*使用锘海组织透明化系列试剂盒及锘海LS18平铺光片显微镜进行三维成像。
锘海LS18平铺光片显微镜采用平铺虚拟扫描光片技术,克服了传统光片显微镜中三维空间分辨率、信噪比和成像视野间的矛盾,可进行更高分辨率的三维成像。通过平铺技术可对光片状态进行实时调节和自动校准,保证其在不同应用中的易用性和稳定性。此外,根据不同样品的特性,LS18还分别提供了优化配件以及流程方案,方便使用者调整成像分辨率、速度、放大倍数等参数以及样本的处理方法,以获得微米级、亚微米级甚至百纳米级三维空间分辨率的多色组织结构信息。配套的三维图像分析软件和常用数据分析方案让使用者可更高效地对结果进行分析和解读,因此LS18被广泛应用于发育、肿瘤、神经等基础生物科研领域以及药物开发、药效检测、临床病理检测等医药领域。
LS-COMPACT是一款用于对多种模式生物和透明化生物组织进行高速、高分辨率三维成像的高性价比多色光片显微镜,可广泛用于基础生物科研和制药、临床诊断等多个领域。LS-COMPACT基于传统光片显微技术,具有实时调节成像模式及参数的功能,可升级为LS18。

锘海生命科学搭建了一站式服务平台,为广大客户提供专业的生物组织透明化、免疫染色、平铺光片显微镜3D荧光成像、数据分析、数据存储等一站式科研服务,旨在通过精细、快速、多样化的科研服务为每一位生命科学工作者提供个体化/定制化的解决方案。















