骨髓(bone marrow,BM)微环境被组织成不同的细胞生态位,以调节造血干细胞和祖细胞(hematopoietic stem and progenitor cell,HSPC)功能的各种稳态和再生方面,包括自我更新、增殖和分化。BM主要由脂肪细胞和造血红细胞(红骨髓)组成,位于骨小梁的空腔内。人类在出生时造血红骨髓占据骨髓空间的大部分,但随着年龄的增长,非造血脂肪骨髓逐渐占优势。骨髓脂肪组织(bone marrow adipose tissue,BMAT,也称为“黄色”骨髓)占健康成人骨髓体积的70%,约占总脂肪量的10%左右。
(来源百度百科)
脂肪组织遍布全身,其形态特征是脂肪细胞含有明显的含脂空泡,通常分为三类:白色、棕色和米色脂肪组织。“What We Talk About When We Talk About Fat”文章中提到:由于与代谢性疾病的关系,再加上身体多余脂肪所带来的美容和心理负担,脂肪细胞可能是被嫌弃的一种细胞类型。以往脂肪组织更是被简单地认为是结缔组织的一种形式,恰好含有脂滴,而没有以任何有意义的方式将其与机体的新陈代谢联系起来。直到20世纪80年代末到90年代中期,由于发现了脂肪来源的血清因子(其中对瘦素和脂联素这两种激素的研究在很大程度上支持了对脂肪组织作为内分泌器官的认识:如瘦素是能量平衡的关键调节因子,是身体长期能量储备的指标。它通过在下丘脑发出信号来调节饱腹感、能量平衡、生育能力和免疫功能),脂肪组织不得不被视为处于能量平衡中心的内分泌器官。位于骨髓空间内的脂肪组织具有不同于髓外脂肪的位置、特征和功能,作为一个被广泛忽视的脂肪库,一直被认为是骨髓微环境中一种相对惰性且不被重视的成分。但是随着越来越多的研究表明,其对造血、成骨、能量代谢,以及作为功能性内分泌组织的贡献,人们越来越认识到BMAT是一种功能特殊的脂肪组织。
在人类中,BMAT占据了骨髓腔的很大一部分,其范围和潜在功能表现出年龄依赖性变化。相比之下,小鼠直到老年时才积累大量的BM脂肪组织。这些物种差异限制了老鼠数据对人类的可翻译性。而恒河猴的造血系统和骨骼系统与人类具有显著的相似性。由于广泛的脂肪浸润导致脂质介导的光散射,人类和非人灵长类动物BM生态位的免疫荧光分析受到限制。虽然骨光学透明化以前曾被用于研究小鼠体内BM生态位的组织,但这种方法并未应用于大型哺乳动物体内BM的透明化。Robino等人就利用恒河猴作为实验动物,扩展了广泛采用小鼠模型的研究,进一步表明BMAT是非人类灵长类动物和可能在人类造血的中心旁分泌调节因子。为了减少脂肪细胞富集的环境所造成的光散射,采用Visikol试剂进行光学组织透明化,助力揭示BMAT和HSPC之间的空间和相互作用关系。该研究实验将股骨横切成两半,在4℃下使用4%多聚甲醛/PBS中固定48小时。固定后,将股骨切成2-3mm相邻的切片。骨切片经过染色(CD31标记内皮,CD34标记HSPC)后,仅经过简单的甲醇梯度脱水,最后每个切片仅使用少量透明化试剂即可完成骨髓的透明化(Visikol Histo-1,Histo-2依次使用2mL)。

图1.恒河猴股骨切片及骨髓透明化前后效果
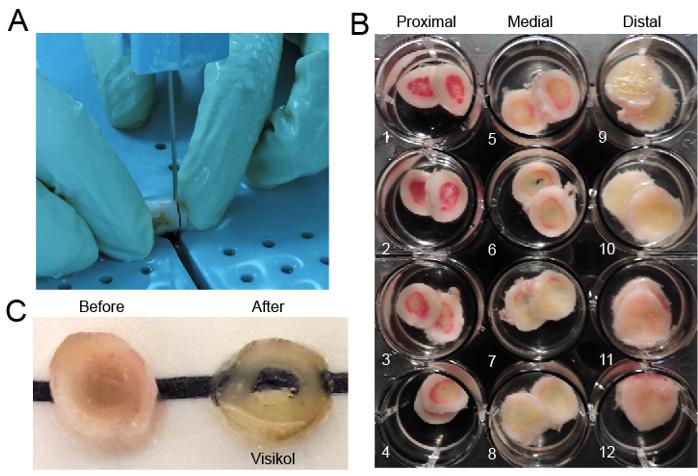
图2.CD34+ HSPC定位于BM脂肪细胞附近
(空腔a处代表脂滴所在部位)
使用Visikol对免疫标记的骨切片进行光学透明化,从而显著提高富含脂质的BM的光学透明度(图1)。对股骨显微成像分析结果显示,CD34+HSPC与BM脂肪细胞质膜紧密相连或直接附着在BM脂肪细胞质膜上(图2A-C、F和G)。最近邻分析显示,大约50%的CD34+HSPC在最近的脂肪细胞10 μm(大约一个细胞直径)内被高概率检测到。HSPC在BM脂肪细胞附近的空间定位与随机点的空间定位显著不同(图2D)。有一小部分HSPC位于CD34+/CD31+内皮附近(图2A箭头,F,G),可能代表BM小动脉。该研究对恒河猴骨髓中HSPCs的空间分布进行了详细的定量分析。该研究表明,采用最近邻距离分析算法来计算HSPCs和BM脂肪细胞之间的接近度,大约一半的成年HSPCs与BM脂肪细胞相关,而其余的HSPCs定位在最近脂肪细胞30 μm范围内, BM细胞和细胞结构之间的共定位和邻近性被广泛认为是其功能相互作用的指示,尤其是BM脂肪组织旁分泌效应的这种作用得到了先前研究的支持,因此,CD34+HSPCs与BM脂肪细胞的空间关联意味着这些细胞类型可能通过局部旁分泌信号进行双向通讯。该研究也证明了Visikol透明化试剂在分析恒河猴富含脂肪细胞的BM中的效用。目前Visikol系列产品,不仅有用于动物组织的透明化试剂,还有可用于3D细胞培养模型透明化、动物胎儿骨成像、以及植物样本透明化等试剂,适用的样本种类多,可应对广大科研工作者各类研究需求。目前Visikol透明化所有产品锘海均代理有售,欢迎垂询!电话:021-37827858 或 13818273779。

参考文献:
Robino JJ, Pamir N, Rosario S, et al. Spatial and biochemical interactions between bone marrow adipose tissue and hematopoietic stem and progenitor cells in rhesus macaques. Bone. 2020;133:115248.
Rosen ED, Spiegelman BM. What we talk about when we talk about fat. Cell. 2014;156(1-2):20-44.
Acar M, Kocherlakota KS, Murphy MM, et al. Deep imaging of bone marrow shows non-dividing stem cells are mainly perisinusoidal. Nature. 2015;526(7571):126-130.
Sulston RJ, Cawthorn WP. Bone marrow adipose tissue as an endocrine organ: close to the bone?. Horm Mol Biol Clin Investig. 2016;28(1):21-38.
Suchacki KJ, Cawthorn WP, Rosen CJ. Bone marrow adipose tissue: formation, function and regulation. Curr Opin Pharmacol. 2016;28:50-56.
Hardouin P, Rharass T, Lucas S. Bone Marrow Adipose Tissue: To Be or Not To Be a Typical Adipose Tissue?. Front Endocrinol (Lausanne). 2016;7:85.
Bukowska J, Frazier T, Smith S, et al. Bone Marrow Adipocyte Developmental Origin and Biology. Curr Osteoporos Rep. 2018;16(3):312-319.
Bani Hassan E, Ghasem-Zadeh A, Imani M, et al. Bone Marrow Adipose Tissue Quantification by Imaging. Curr Osteoporos Rep. 2019;17(6):416-428.
Li Y, Meng Y, Yu X. The Unique Metabolic Characteristics of Bone Marrow Adipose Tissue. Front Endocrinol (Lausanne). 2019;10:69.
组织透明化染色、大组织3D荧光成像科研服务
Cubic组织透明化使3D成像变得更简单





